
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общие свойства растворов
|
|
|
|
Классификация растворов
Введение
Растворы
Очень многие химические реакции, в том числе технические и жизненно важные, протекают в жидкой фазе.
Растворы широко применяются в различных сферах деятельности человека. Они имеют большое значение для живых организмов. Человек, животные и растения усваивают питательные вещества в виде растворов. Растворами являются физиологические жидкости – плазма крови, лимфа, желудочный сок и др. Многие медицинские препараты являются растворами различных химических веществ в воде или в спирте.
Природная вода является раствором. В различных производственных и биологических процессах большую роль играют растворы электролитов. Свойства этих растворов объясняет теория электролитической диссоциации. Знание теории электролитической диссоциации является основой для изучения свойств неорганических и органических соединений и глубокого понимания механизмов химических реакций в растворах.
Растворами называют однородные системы, состоящие из двух или нескольких компонентов, состав которых можно изменять в определенных пределах без нарушения однородности.
Растворителем называется компонент, концентрация которого выше концентрации других компонентов.
Раствор это не механическая смесь, поскольку при растворении наблюдаются объемные и энергетические эффекты.
Раствор отличается от механической смеси гомогенностью, а от химического соединения:
a) переменным составом – от нуля до предела насыщения;
б) тем, что изменение свойств растворителя и растворённого вещества не носит радикальный характер.
Растворение – это самопроизвольный процесс, заключающийся во взаимодействии растворенного вещества с молекулами растворителя. Точка зрения Д. И. Менделеева:
раствор - это сложная равновесная химическая система, образованная растворителем, растворенным веществом и продуктами их взаимодействия.
Различают истинные и коллоидные растворы.
Истинные растворы - размер частиц ~10-10…10-11 м, т.е. атомы или молекулы.
Коллоидные растворы - размер частиц ~ 10-8… 5×10-10 м
Растворы бывают:
1) газообразные: газ-газ;
2) жидкие: газ-жидкость,
жидкость-жидкость,
твердое вещество – жидкость;
3) твердые: газ - твердое вещество,
твердое вещество - твердое вещество.
Жидкие растворы могут быть водные и неводные. Водные растворы – это растворы, в которых растворителем является вода.
Твёрдым раствором называется кристалл, кристаллическая решётка которого состоит из двух или более компонентов.
Растворы делятся на электролиты и неэлектролиты. Вещества, которые в растворе или расплаве полностью или частично распадаются на ионы и проводят электрический ток, называются электролитами.
Идеальным называется раствор, в котором не происходит химической реакции между компонентами, а силы межмолекулярного взаимодействия между взаимодействующими компонентами одинаковы.
Общие (коллигативные) свойства растворов те, которые не зависят от природы растворённых веществ, а зависит от количества растворенного вещества.
1.2.1 Закон Рауля:
понижение давления насыщенного пара растворителя над раствором пропорционально мольной доле растворённого нелетучего вещества:
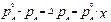 , (10.1)
, (10.1)
где  и
и  – давление насыщенного пара растворителя над чистым растворителем и над раствором, Па;
– давление насыщенного пара растворителя над чистым растворителем и над раствором, Па;
х – мольная доля.
Первое следствие из закона Рауля: повышение температуры кипения DТкип пропорционально моляльной концентрации раствора:
DТкип= Кэ×Сm, (10.2)
где Кэ – эбулископическая постоянная растворителя,
Сm – моляльная концентрация, моль/1000 г.
Второе следствие из закона Рауля: понижение температуры замерзания DТзам пропорционально моляльной концентрации раствора:
DТкип=Кк×Сm, (10.3)
где Кк – криоскопическая постоянная.
Кк и Кэ – зависят от природы растворителя:
 (10.4)
(10.4)
где DНкип – удельная теплота испарения,  ;
;
Ткип – температура кипения чистого растворителя, К;
R – газовая постоянная,  .
.
 , (10.5)
, (10.5)
где DНкриc. – удельная теплота кристаллизации,  ;
;
Т крит . – температура кристаллизации чистого растворителя, К.
1.2.2 Осмотическое давление
Если система, разделённая мембраной, представляет собой растворы, в которых через мембрану способны проходить только молекулы растворителя, то свойства ее будут определяться разностью мольных долей (концентраций) растворителя по обе стороны мембраны.
Явление, связанное со способностью проходить через мембрану, в частности, только молекул растворителя, называется осмосом, а вызываемое им изменение давления по обе стороны мембраны – осмотическим давлением. Явление осмоса чрезвычайно разнообразно и во многом определяется природой мембраны и компонентов раствора.
Представим, что сосуд с двумя горлами для добавления раствора разделён мембраной (рисунок 1). В каждую часть сосуда зальём растворы, отличающиеся только концентрацией. Поскольку мольные доли растворителя по обе стороны мембраны не совпадают, то стремление их к выравниванию приведёт к переходу части растворителя в ту часть сосуда, где концентрация растворённого вещества больше. Увеличение количества растворителя эквивалентно возрастанию давления, и если мембрана способна к деформации, она изогнётся в сторону с меньшей концентрацией растворённого вещества (рисунок 1а). Если мембрана жёсткая, то в отсеке с большой концентрацией количество растворителя будет возрастать до тех пор, пока гидростатическое давление h (рисунок 1а) не станет равным осмотическому давлению и не прекратит осмос.
Если внешнее давление больше атмосферного и приложено к более концентрированному раствору, то растворитель будет переходить в разбавленный раствор – обратный осмос.
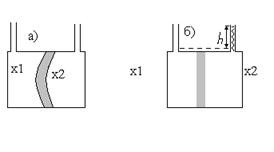
Рисунок 10.1 - Схема разности осмотических давлений при концентрации x1<x2 при эластичной (а) и жесткой (б) мембранах
Осмотическое давление π – внутреннее давление растворенного вещества, численно равное тому внешнему давлению, которое нужно приложить, чтобы прекратить осмос; оно зависит от температуры и концентрации.
Согласно Вант-Гоффу осмотическое давление раствора численно равно тому газовому давлению, которое имело бы растворённое вещество, будучи переведенным в газообразное состояние в том же объёме и при той же температуре. Поскольку объем (разбавление) обратно пропорционален концентрации, то закон Вант-Гоффа можно записать в виде:
π = СМ.R.T, (10.6)
где СМ – молярная концентрация, моль/л.
Если растворы характеризуются одинаковыми осмотическими давлениями, то по Вант-Гоффу такие растворы называются изотоническими. Независимо от природы растворённого вещества, изотоничность является следствием одинакового числа частиц в растворе.
Поскольку при растворении реальное число частиц может отличаться от числа растворённых молекул, Вант-Гофф ввёл понятие изотонического коэффициента i. По определению это отношение числа всех частиц к числу растворённых молекул:
i = число частиц в растворе / число молекул в растворе. (10.7)
В бензольном растворе уксусной кислоты i < 1, ибо в этом растворе число частиц меньше числа молекул, в результате реакции ассоциации в соответствие с уравнением 2CH3COOH = (CH3COOH)2.
Если же в растворе преобладает не ассоциативный, а диссоциативный или ионизационный механизмы взаимодействия, то i > 1. Так, в одном растворе уксусная кислота диссоциирует:
CH3COOH = CH3COO- + H+,
и число частиц становится больше числа молекул.
1.2.3 Закон распределения Нернста – Шилова:
при постоянной температуре соотношение равновесных концентраций между несмешивающимися жидкостями является величиной постоянной, независимой от общего количества компонентов:
 , (10.8)
, (10.8)
где Крас – коэффициент распределения;
Са и Сb – молярные концентрации веществ в растворах А и В, моль/л.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 6603; Нарушение авторских прав?; Мы поможем в написании вашей работы!