
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория кислот и оснований
|
|
|
|
Термодинамика процессов растворения
Движущими силами образования растворов являются энтропийный и энтальпийный факторы. При растворении газов в жидкости энтропия всегда уменьшается (ΔS<0), а при растворении кристаллов возрастает (ΔS>0). Чем сильнее взаимодействие растворённого вещества и растворителя, тем больше роль энтальпийного фактора в образовании растворов. Знак изменения энтальпии растворения определяется знаком суммы всех тепловых эффектов процессов, сопровождающих растворение, из которых основной вклад вносят разрушение кристаллической решётки на свободные ионы (ΔН > 0) и взаимодействие образовавшихся ионов с молекулами растворителя (сольтивация, ΔН < 0). При этом независимо от знака энтальпии при растворении (абсолютно нерастворимых веществ нет) всегда ΔG = ΔH – T.ΔS < 0, т. к. переход вещества в раствор сопровождается значительным возрастанием энтропии вследствие стремления системы к разупорядочиванию. Для жидких растворов (расплавов) процесс растворения идёт самопроизвольно (ΔG < 0) до установления динамического равновесия между раствором и твердой фазой.
При растворении выделяют три основных процесса (с точки зрения термодинамики):
а) разрушение химических и межмолекулярных связей, требующее затраты энергии ΔH1>0;
б) химическое взаимодействие растворителя и растворённого вещества с образованием сольватов – выделение энергии ΔH2<0;
в) самопроизвольное равномерное распределение сольватов в растворителе: ΔH3>0.
Суммарный тепловой эффект ΔH= ΔH1+ ΔH2+ ΔH3.
ΔH<0 – экзотермическое растворение.
ΔH>0 – эндотермическое растворение.
Равновесие ΔG=0, ΔG= ΔH+TΔS – насыщенный раствор.
Множество химических реакций может быть рассмотрено с позиций кислотно-основных взаимодействий. Такие вопросы, как трактовка механизмов реакций, кислотный и основной катализ, влияние различных факторов на ход процесса, в основном базируются на учете кислотно-основных взаимодействий. Овладеть оценкой кислотно-основных взаимодействий - это значит понять сущность химической реакции и иметь возможность управлять ею.
Рассмотрим кратко эволюцию взглядов на природу кислот и оснований. Термины "кислоты" и "основания" сформировались еще в XVII веке, однако их содержание неоднократно пересматривалось и уточнялось. Лишь в конце прошлого века после появления теории электролитической диссоциации (С.Аррениус, 1887 год) сформировалась первая научная ионная теория кислот и оснований (Д.Оствальд, С.Аррениус, 1890 год).
Важной вехой в развитии взглядов на кислоты и основания явилось сформулированное А. Ганчем в 1917-1927 годах понятие об амфотерности - способности некоторых соединений проявлять как кислотные, так и основные свойства в зависимости от условий и природы реагентов, участвующих в кислотно-основном взаимодействии. И, как оказалось позже, таких соединений (проявляющих амфотерность) - подавляющее большинство. В зависимости от природы партнера по взаимодействию явная кислота может выступать в роли основания и наоборот.
Доминирующие в настоящее время протонная (И. Бренстед и Т.Лоури) и электронная (Г. Льюис) теории кислот и оснований были предложены одновременно в 1923 году. Сущность этих теорий будет рассмотрена ниже в данных методических рекомендациях.
Академиком АН Казахской ССР физиком-химиком М.И. Усанович была предпринята попытка объединить электронную и протонную теории. В 1930-х годах М.И. Усанович доказал несостоятельность разделения электролитов на «нормальные» и «аномальные». По его мнению, так называемая аномальная электрическая проводимость должна рассматриваться не как исключение, а как правило. В 1938 г. М.И. Усанович разработал оригинальную теорию кислот и оснований, положив в основу представление, что водород не является универсальным носителем кислотных свойств. Он отнес к кислотам все вещества, образующие соли при взаимодействии с основаниями. Все окислительно-восстановительные и протолитические реакции оказывались частным случаем кислотно-основных взаимодействий. Кроме того, М.И. Усанович считал, что амфотерность присуща всем полярным соединениям.
В современной химии используются две теории кислот и оснований: теория Бренстеда-Лоури и теория Льюиса-Усановича. Более общие определения кислот и оснований предложены в теории Льюиса - Уеановича.
Для описания кислотно-основных равновесий в водных растворах применяют классическую теорию Аррениуса.
Теория электролитической диссоциации С. Аррениус содержит следующие положения:
1. При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации).
2. Под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+).
3. Электролитическая диссоциация - процесс обратимый (обратная реакция называется моляризацией).
4. Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n), к общему числу молекул, введенных в раствор (N).
a = n / N, 0<a<1. (10.10)
Кислотой называют электролит, диссоциирующий в растворах с образованием ионов Н+; основанием называют электролит, диссоциирующий в воде с образованием гидроксид-ионов ОН . Амфолитом (амфотерным гидроксидом) называют электролит, диссоциирующий в воде с образованием как ионов Н+, так и ионов ОН
. Амфолитом (амфотерным гидроксидом) называют электролит, диссоциирующий в воде с образованием как ионов Н+, так и ионов ОН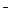 :
:
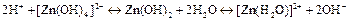 .
.
Общепринятыми считаются протонная теория электролитической диссоциации Бренстеда-Лоури и электронная теория Льюиса. Протонная теория Бренстеда-Лоури применима лишь к протонсодержащим или протонприсоединяющим веществам. Согласно этой теории кислотойназывается вещество, способное быть донором протонов, а основанием – вещество, которое может присоединить (акцептировать) протон:
HAn =H++ An-.
По определению, HАn – кислота, An- - основание, сопряженное с этой кислотой. Любой кислоте соответствует сопряженное с ней основание.
NH3 + H+=NH4+
Любое кислотно-основное равновесие включает взаимодействие двух пар кислот и оснований.
сопряженная пара
 |
Кислота1 + Основание2 = Основание1 + Кислота2
 | ||||||
 |  | |||||
 |
сопряженная пара
В определённых условиях многие вещества могут вести себя как кислота или как основание. Эти два понятия неразделимы, а потому правильнее говорить о кислотно-основных свойствах данного вещества.
Электронная теория Льюиса допускает, что участие в кислотно-основном равновесии протона необязательно, поэтому её называют апротонной. Согласно апротонной (электронной) теории, кислотой называется вещество, способное присоединять электронную пару, а основанием – вещество, способное отдавать электронную пару.
При взаимодействии донора электронной пары NF3(основание) и акцептора электронной пары BF3 (кислота) образуется более устойчивое электронное окружение (октет) за счёт донорно-акцепторной (двухэлектронной двухцентровой) связи.
Ни кислота, ни основание протонов не содержат.
В периоде сила кислородсодержащей кислоты растёт с увеличением заряда и с уменьшением радиуса иона кислотообразующего элемента:
H4SiO4<H3PO4<H2SO4<HClO4.
В пределах одной группы элементов сила кислоты уменьшается по мере увеличения радиуса кислотообразующего элемента:
HClO3 > HBrO3 > HIO3.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1618; Нарушение авторских прав?; Мы поможем в написании вашей работы!