
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механизм электролитической диссоциации полярных веществ
|
|
|
|
Растворимость твердых веществ в жидкостях увеличивается с увеличением температуры, давление практически не влияет. Добавки посторонних веществ снижают растворимость данного вещества - меньше свободных молекул растворителя (эффект высаливания).
Растворимость твердых веществ в жидкостях
Растворимость жидкостей в жидкостях может быть полной (спирт-вода), ограниченной (вода-анилин). Растворимость жидкости в жидкости растет с температурой и при некоторой критической температуре наблюдается полная взаимная растворимость.
Растворение газа в жидкости - процесс экзотермический, с ростом температуры растворимость уменьшается (принцип Ле Шателье). Растворимость газов пропорциональна их парциальным давлениям - закон Генри.
Растворимость газов в жидкостях
Высокая растворимость может быть следствием образования водородных связей (спирт-вода).
Скорость растворения твердых веществ зависит от их дисперсности – измельченный порошок растворяется быстрее первоначального продукта.
На кафедре неорганической химии С.-Петербургского университета, которую возглавлял с 1934 по 1977 г. С.А.Щукарев, проводились термохимические исследования растворов электролитов и твердых фаз. В соответствии с законом С.А.Щукарева, скорость процесса кристаллизации и обратного процесса растворения определяется скоростью подвода или отвода вещества к поверхности кристалла и описывается уравнением:
 , (10.9)
, (10.9)
где b - коэффициент массоотдачи;
Cp - концентрация насыщения;
C - концентрация пересыщения;
F - поверхность кристалла.
Сольватация – взаимодействие между молекулами и ионами растворяемого вещества и молекулами растворителя состоит из нескольких стадий: молекулярная диссоциация, образование сольватов, ионизация и электролитическая диссоциация:
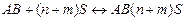 , стадия(a) - процесс образования сольватов
, стадия(a) - процесс образования сольватов
где АВ – молекулы растворяемого вещества;
S – молекулы растворителя.
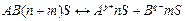 , стадия(b) - электролитическая диссоциация.
, стадия(b) - электролитическая диссоциация.
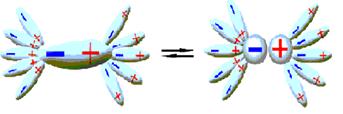
Рисунок 10.2 – Процесс образования сольватов
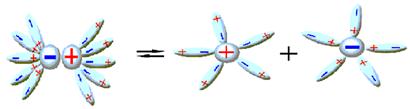
Рисунок 10.3 – Электролитическая диссоциация
Если процесс сольватации останавливается на стадии (a), то образуется раствор неэлектролита (подчиняется законам Рауля, Вант – Гоффа: раствор сахара в воде).
Если процесс протекает до стадии (b), то система является раствором электролита: растворы щелочей, солей, неорганических кислот в воде
1.3.4 Механизм электролитической диссоциации ионных веществ.
При растворении соединений с ионными связями (например, NaCl) процесс гидратации начинается с ориентации диполей воды вокруг всех выступов и граней кристаллов соли.
Ориентируясь вокруг ионов кристаллической решетки, молекулы воды образуют с ними либо водородные, либо донорно-акцепторные связи. При этом процессе выделяется большое количество энергии, которая называется энергией гидратации.
Энергия гидратации, величина которой сравнима с энергией кристаллической решетки, идет на разрушение кристаллической решетки. При этом гидратированные ионы слой за слоем переходят в растворитель и, перемешиваясь с его молекулами, образуют раствор.
Аналогично диссоциируют и вещества, молекулы которых образованы по типу полярной ковалентной связи. Вокруг каждой полярной молекулы вещества (например, HCl), определенным образом ориентируются диполи воды. В результате взаимодействия с диполями воды полярная молекула еще больше поляризуется и превращается в ионную, далее уже легко образуются свободные гидратированные ионы.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1033; Нарушение авторских прав?; Мы поможем в написании вашей работы!