
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химия железа и его соединений
|
|
|
|
Химия марганца и его соединений
Так же, как и хром, в природе марганец встречается в виде оксидов: пиролюзита MnO2, гаусманита Mn3O4, браунита Mn2O3. Встречается марганец и в железных рудах. Совместным восстановлением железных и марганцевых руд получают ферромарганец, содержащий 80-85% марганца и используемый в производстве стали и чугуна. Чистый марганец получают алюминотермией или электролизом растворов сульфата или хлорида марганца.
Марганец - серебристо-белый твердый и хрупкий металл. Марганец вытесняет водород из соляной кислоты, реагирует с серной и азотной кислотами:
Mn + 2HCl ® MnCl2 + H2
Mn + 2H2SO4 ® MnSO4 + SO2 + 2H2O
3Mn + 8HNO3 (1:1) ® 3Mn(NO3)2 + 2NO + 4H2O
Марганец образует несколько оксидов. С повышением степени окисления марганца, свойства этих оксидов изменяются: оксиды марганца (II и III) - основные, оксид марганца (IV) - амфотерный, оксиды марганца (VI и VII) - кислотные.
Нерастворимый в воде гидроксид марганца (II) может быть получен действием щелочей на соли марганца:
MnSO4 + 2NaOH ® Mn(OH)2¯ + Na2SO4
Гидроксид марганца(II) имеет основные свойства (но не кислотные):
Mn(OH)2¯ + 2NaOH ¹
Mn(OH)2¯ + H2SO4 ® MnSO4 + 2H2O
а также восстановительные свойства, он окисляется на воздухе:
2Mn(OH)2¯ + O2 ® MnO2¯ + 2H2O
Действием сильных окислителей, таких как висмутат натрия NaBiO3 или оксид свинца(IV) PbO2, соли марганца(II) могут быть окислены в кислой среде до фиолетовой марганцовой кислоты HMnO4.
2Mn(NO3)2 + 16HNO3 + 5NaBiO3 ® 2HMnO4 + 5Bi(NO3)3 +
+ 5NaNO3 + 7H2O
Устойчивый оксид марганца(IV) MnO2 имеет амфотерные свойства и растворяется в кислотах и щелочах. В кислой среде MnO2 является сильным окислителем, способным выделить хлор из соляной кислоты:
MnO2 + 4HCl ® MnCl2 + Cl2 + 2H2O
Оксид марганца(VI) MnO3 и соответствующая ему марганцовистая кислота H2MnO4 неустойчивы. Несколько более устойчивы соли этой кислоты - манганаты, например, K2MnO4, имеющие в растворах зеленый цвет.
Марганцовая кислота HMnO4 и соответствующие ей соли - перманганаты, например, KMnO4, имеют в растворах характерный фиолетовый цвет. Пеманганаты являются сильными окислителями, особенно в кислой среде. Продуктами восстановления перманганат-ионов могут быть ионы Mn2+ (бесцветный раствор в кислой среде), черно-бурый осадок MnO2 (в нейтральной или слабощелочной среде) или ионы MnO42- (зеленый раствор в сильнощелочной среде):
2KMnO4 + 3H2SO4 + 5Na2SO3 ® 2MnSO4 + 5Na2SO4 + K2SO4 +
+ 3H2O
2KMnO4 + H2O + 3Na2SO3 ® 2MnO2 + 3Na2SO4 + 2KOH
2KMnO4 + 2KOH + Na2SO3 ® 2K2MnO4 + Na2SO4 + H2O
Железо является вторым после алюминия металлом по распространенности в природе. Основные руды: магнетит Fe3O4, гематит Fe2O3, лимонит 2Fe2O3×3H2O, пирит FeS2. Из руд железо получают восстановлением углеродом в домнах. Получаемое при этом железо содержит около 4% углерода и называется чугуном. При переработке чугуна получают стали, в которых содержание углерода составляет 0,2-2,0%.
Железо является достаточно активным металлом и растворяется в соляной и разбавленных азотной и серной кислотах.
Fe + 2HCl ® FeCl2 + H2
Fe + H2SO4 (разб.) ® FeSO4 + H2
Fe + HNO3 (разб.) ® Fe(NO3)3 + NO + H2O
Концентрированные серная и азотная кислоты на холоду пассивируют железо (как и алюминий, и хром)
Нерастворимый в воде оксид железа(II) FeO имеет основные свойства и растворяется в кислотах, но не в щелочах:
FeO + H2O ¹
FeO + H2SO4 ® FeSO4 + H2O
Зеленоватый осадок гидроксида железа(II) Fe(OH)2 получают действием щелочей на соли железа(II).
FeSO4 + 2NaOH ® Fe(OH)2¯ + Na2SO4
Fe(OH)2 имеет основные свойства:
Fe(OH)2¯ + Н2SO4 ® FeSO4 + 2H2O
Fe(OH)2¯ + 2NaOH ¹
и легко окисляется кислородом воздуха до бурого гидроксида железа (III), проявляя восстановительные свойства:
4Fe(OH)2¯ + 2H2O + O2 ® 4Fe(OH)3¯
Красно-бурый осадок гидроксида железа(III) Fe(OH)3 получают действием щелочей на соли железа(III).
FeCl3 + 3NaOH ® Fe(OH)3¯ + 3NaCl
Гидроксид железа (III) имеет амфотерные свойства. Его основные свойства слабее, чем у Fe(OH)2, а его кислотные свойства слабее его основных свойств и проявляются лишь в очень жестких условия, например, при сплавлении.
Fe(OH)3¯ + 3HCl ® FeCl3 + 3H2O
Fe(OH)3¯ + NaOH ¹ не идет в растворе
Fe(OH)3¯ + NaOH 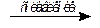 NaFeO2 + H2O
NaFeO2 + H2O
В кислой среде ионы железа(III) являются окислителями и переходят в ионы железа(II):
FeCl3 + 2HI ®2FeCl2 + I2 + 2HCl
В щелочной среде сплавлением с нитратом калия из соединений железа(III) могут быть получены соединения железа(III) - соли железной кислоты - ферраты:
Fe2O3 + 3KNO3 + 4KOH 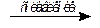 2K2FeO4 + 3KNO2 + 2H2O
2K2FeO4 + 3KNO2 + 2H2O
Ионы железа(II) и железа(III) образуют многочисленные комплексные соединения с молекулами воды, аммиака, ионами Cl-, F-, CN-, SCN- и другими лигандами:
FeSO4 + 6KCN ® K4[Fe(CN)6] + K2SO4
FeCl3 + 6KCN ® K3[Fe(CN)6] + 3KCl
Интенсивная кроваво-красная окраска роданида железа(III) Fe(SCN)3 служит для обнаружения ионов железа(III) в растворе.
FeCl3 + 3KCNS ® Fe(SCN)3 + 3KCl
Гексациано(II)феррат калия K4[Fe(CN)6] образует с ионами железа(III) темно-синий осадок берлинской лазури, что также используется для обнаружения ионов железа(III) в растворе:
K4[Fe(CN)6] + FeCl3 ® KFe[Fe(CN)6]¯ + 3KCl
Гексациано(III)феррат калия K3[Fe(CN)6] образует с ионами железа(II) темно-синий осадок турнбулевой сини, что используется для обнаружения ионов железа(II) в растворе:
K3[Fe(CN)6] + FeSO4 ® KFe[Fe(CN)6]¯ + K2SO4
Биологическое значение железа велико, железо - составная часть гемоглобина крови.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 383; Нарушение авторских прав?; Мы поможем в написании вашей работы!