
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Внутренняя энергия, энтальпия
|
|
|
|
ЭНЕРГЕТИКА ПРОЦЕССОВ
ВВЕДЕНИЕ
Соловьев С.Н.
С 60 Начала химии. Теоретические основы химии. Конспект лекций, задачи и упражнения. М.: РХТУ им. Д.И. Менделеева. 2004. 148 с.
ISBN 5-7237-0463-Х
В пособии рассматриваются: элементы химической термодинамики; основы учения о равновесии; равновесия в растворах электролитов; комплексные соединения; эквивалент и закон эквивалентов.
УДК 546 (075.8)
ББК 24.1:24.53
ISBN 5-7237-0463-Х
© Российский химико-технологический университет им. Д.И. Менделеева, 2004
© Соловьев С.Н., 2004
В вузах химического и химико-технологического профиля изучению неорганической химии обычно предшествует дисциплина, где излагаются основные закономерности протекания химических процессов и современные представления о строении вещества. Традиционно в нее включаются элементы химической термодинамики, основы учения о равновесии и рассмотрение ряда важнейших равновесий в водных растворах, общие сведения о протекании химических реакций; элементы теории строения молекул и химической связи, представления о межмолекулярном взаимодействии, теория химической связи в комплексных соединениях и общая информация об этих соединениях.
Данное пособие представляет собой первую часть сжатого конспекта лекций по теоретическим основам химии, оно содержит большое число разобранных задач и заданий, закрепляющих усвоение основного лекционного материала и дающих практические навыки его использования. Такое сочетание лекционного и семинарского материала позволяет самостоятельно изучать необходимые разделы курса, готовиться к зачетам и экзаменам.
В пособие включен материал по следующим разделам курса: элементы химической термодинамики, учение о равновесии, равновесия в растворах, окислительно-восстановительные реакции, комплексные соединения, эквиваленты и закон эквивалентов.
Пособие будет полезно студентам медицинских, химических и технологических вузов, старшеклассникам, занимающимся углубленным изучением химии, и их педагогам.
Химическая термодинамика, элементы которой используются в общехимических курсах, оперирует так называемыми характеристическими функциями или функциями состояния, позволяющими через значения самих функций и их производных определить любое термодинамическое свойство. Познакомимся с некоторыми из них.
Системой в термодинамике называют тело (вещество, несколько веществ) или группу взаимодействующих тел, мысленно выделяемых, обособляемых от окружающей среды. Примеры систем: Земля, колонна синтеза аммиака, пробирка с реактивами. Система, имеющая постоянный объем и рассматриваемая как необменивающаяся веществом и энергией с окружающей средой, называется изолированной. Создать действительно изолированную систему практически невозможно.
Движение представляет собой неотъемлемое свойство материального мира, мерой движения является энергия. Теплота и работа представляют собой виды энергии. В первом случае (теплота) энергия передается путем хаотического столкновения молекул на границе соприкасающихся тел. Работа качественно разнообразна (работа в поле тяготения, работа электрического поля, работа расширения и т.д.), отражая различные виды взаимодействия, и характеризуется перемещением большого числа частиц.
Закон сохранения энергии (или первый закон термодинамики) утверждает: теплота Q, поведенная к системе, расходуется на совершение системой работы A и на изменение ее внутренней энергии DU:
Q = DU + A. (1.1)
Внутренняя энергия представляет собой однозначную, конечную и непрерывную (а значит, и дифференцируемую!) функцию состояния, аргументами которой являются температура, давление, природа и число молей вещества и т.д. Как дифференцируемая функция внутренняя энергия обладает свойством независимости ее изменения при переходе от начального состояния (1) к конечному (2) от пути перехода:
DU=U2 – U1. (1.2)
А вот теплота в общем случае не является дифференцируемой функцией.
Внутренняя энергия системы подразумевает общий ее запас, включая энергию поступательного и вращательного движения молекул, внутримолекулярную энергию электронов, внутриядерную энергию и т.д. Фактически абсолютная ее величина зависит от уровня наших знаний о различных видах энергии, а также о фундаментальных частицах и характере их взаимодействия. Поэтому до тех пор пока не решена проблема существования последней фундаментальной частицы, сама проблема определения абсолютного значения внутренней энергии лишена смысла.
Обычно работу разделяют на полезную и работу расширения:
А = Апол + Арасш . (1.3)
Работа расширения может быть найдена следующим образом:
 , (1.4)
, (1.4)
где Р - давление, V - объем.
Для изобарного процесса (P=const) уравнение (1.4) принимает вид:
 . (1.5)
. (1.5)
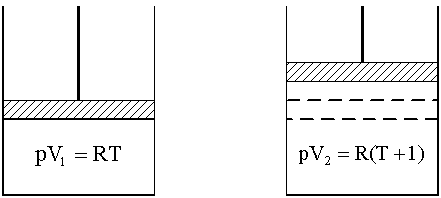
Рис. 1. К пояснению физического смысла газовой постоянной
Отметим, что любая химическая система, в которой происходит изменение объема, будет характеризоваться работой расширения. В связи
с обсуждением этой величины обратимся к физическому смыслу универсальной газовой постоянной R. Рассмотрим систему, содержащую 1 моль идеального газа, находящегося при постоянном давлении в цилиндре под невесомым поршнем, двигающемся без трения. Систему нагрели на 1 K, газ расширился, поршень поднялся, совершена работа расширения (рис.1).
Состояния газа описываются уравнением Менделеева-Клапейрона для начального состояния системы PV1 = RТ и для конечного состояния PV2 = R (Т+1). Работа расширения согласно (1.4) и (1.5) составит:
Арасш = PDV = PV2 – PV1 = R (T+1) – RT = R.
Таким образом, численное значение универсальной газовой постоянной равно работе расширения 1 моль идеального газа, находящегося при постоянном давлении, при нагревании на 1 К.
Рассмотрим систему при постоянном давлении, для которой отсутствует полезная работа (Апол = 0). Согласно соотношениям (1.1) и (1.5):
QP=DU+Aрасш = DU+PDV=U2–U1+PV2–PV1=U2+PV2–(U1+PV1). (1.6)
Вводим новую термодинамическую функцию, называемую энтальпией, которая определяется соотношением:
H = U+РV. (1.7)
Соответственно выражение (1.6) приобретает вид:
QP=H2–H1=DH. (1.8)
Как видно из определения, энтальпия будет обладать свойством независимости ее изменения при переходе от начального состояния к конечному от пути перехода; она является однозначной, конечной и непрерывной функцией состояния. Абсолютные значения энтальпий, как и абсолютные значения величин внутренней энергии, неизвестны.
Поэтому в учебной и научной литературе слово "изменение" в выражениях типа "изменение энтальпии (внутренней энергии) в процессе" опускают и говорят об "энтальпии (внутренней энергии) процесса", понимая под этим величины DH и DU. Подчеркнем, что изобарный режим (в основном Р=1 атм) является наиболее распространенным для лабораторной и промышленной реализации различных процессов.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 909; Нарушение авторских прав?; Мы поможем в написании вашей работы!