
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Равновесие диссоциации воды, буферные растворы
|
|
|
|
Пример 1. Определить рН: а) 0,01М раствора HI; б) 0,01М раствора CsOH; в) 0,01М раствора СН3СООН, Кдис = 1,75×10–5.
Решение: a) HI в водном растворе является сильным электролитом, поэтому: [HI] = [H+] =0,01 моль/л. Отсюда рН = – lg 0,01 = 2.
6) CsOH – сильный электролит, поэтому: [CsOH] = [OH–] = 0,01 моль/л.
Отсюда рОН = – lg 0,01 = 2, а рН = 14 – 2 = 12.
в) CH3COOH – слабый электролит в водном растворе, уравнение диссоциации:

Определим концентрацию ионов водорода:


Затем находим рН раствора:
pH = – lg [H+] = –lg 4,18×10-4 = 3,38.
Пример 2. рН 0,1 М раствора слабого однокислотного основания равен 11. Найти константу и степень диссоциации этого основания.
Решение. Диссоциация слабого однокислотного основания описывается схемой:

Если рН раствора равен 11, то рОН =14–11=3; отсюда [OH–]=1×10–3 моль/л. В соответствии с уравнением диссоциации:
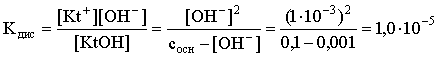

Пример З. Определить рН буферного раствора, полученного смешением 1 л 0,1 М раствора СН3СООН и 2 л 0,01 М раствора CH3COONa. Считать объем окончательного раствора равным З л. Кдис СН3СООН = 1,75×10–5.
Решение. В водных растворах СН3СООН и CH3COONa реализуются следующие равновесия:


Диссоциация слабой кислоты подавлена диссоциацией соли, имеющей тот же анион, что и кислота. В силу этого:
[CH3COO-] = [CH3COO-]к-ты + [CH3COO-]соли» ссоли;
[CH3COOH]» ск-ты .
Учитывая это, запишем для Кдис кислоты и [Н+]:

С учетом разбавления концентрации соли и кислоты составят:
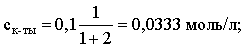

Находим из константы диссоциации концентрацию ионов водорода и рН раствора:
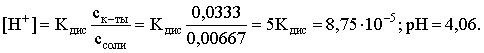
Пример 4. Какой объем 0,5 М раствора ацетата натрия следует прилить к 1 л 0,1 М раствора СН3СООН, чтобы рН полученного буферного раствора составил 5. Считать, что объем полученного раствора равен сумме объемов сливаемых растворов; Кдис СH3COOH =1,75×10–5.
Решение. В соответствии с формулой (3.21) для кислого буферного раствора

Отсюда:

Пусть для получения требуемого раствора к 1 л 0,1 М раствора СН3СООН следует прибавить Х л 0,5 М раствора CH3COONa. Соответственно, тогда
в буферном растворе:
 моль/л;
моль/л;
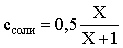 моль/л.
моль/л.
Подставляем эти величины в написанное выше соотношение:

Таким образом, для получения раствора с требуемой величиной рН необходимо к 1 л 0,1 М раствора СН3СООН добавить 350 мл 0,5 М раствора CH3COONa.
Пример 5. На сколько единиц изменится рН раствора слабой одноосновной кислоты при его разбавлении в 10 раз?
Решение. Константа диссоциации слабой одноосновной кислоты имеет вид (см. пример 1 этого раздела):

Имея в виду равенство констант диссоциации кислоты в растворах двух концентраций, запишем:
 или
или
 .
.
Логарифмируем это соотношение:
2 lg [H+]1 = 1 + 2lg [H+]2.
Делим обе части уравнения на 2 и меняем знаки:
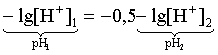
pH1 = pH2 – 0,5.
Следовательно, при разбавлении раствора слабой одноосновной кислоты в 10 раз рН раствора возрастает на 0,5.
Пример 6. Вычислить рН насыщенного раствора Mg(OH)2. ПР Mg(OH)2 = = 1,47×10–11.
Решение. В насыщенном растворе Mg(OH)2 существует равновесие:
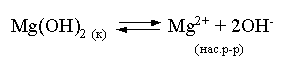
Пусть растворимость гидроксида магния в воде равна Р моль/л, тогда концентрации ионов в насыщенном растворе составят: [Mg2+] = P, [OH–] = 2P.
Подставляем эти величины в выражение для ПР:
ПР = [Mg2+] [OH–]2 = P(2P)2 = 4P3 = 1,47×10–11.
Находим рН насыщенного раствора гидроксида магния:
 ; [OH–] = 2P = 3,08×10–4.
; [OH–] = 2P = 3,08×10–4.
pOH = –lg 3,08×10–4 = 3,51; pH = 14 – 3,51 = 10,49.
Пример 7. Определить рН, при котором начинается осаждение Fе(ОН)3 из 0,1 М раствора FeCl3. ПР Fe(OH)3 = 6,40×10–40.
Решение. Пусть растворимость Fe(OH)3 в 0,1 М растворе FeCl3 составляет Р моль/л. Тогда в соответствии с уравнением растворения и диссоциации Fе(ОН)3

концентрации ионов в насыщенном растворе Fe(ОН)3 составят: [OH–]= 3P; [Fe3+] = 0,1 + P. Подставляем эти величины в выражение для ПР:
ПР Fe(OH)3 = [Fe3+][OH–]3 = (0,1+P)(3P)3» 2,7P3 = 6,40×10–40;
находим концентрацию ионов ОН– и рН начала выпадения Fе(ОН)3 из 0,1 М раствора FeCl3
 ; [OH–] = 3P = 1,86×10–13.
; [OH–] = 3P = 1,86×10–13.
pOH = –lg 1,86×10–13 = 12,7; pH = 14 – pOH = 1,3.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 3956; Нарушение авторских прав?; Мы поможем в написании вашей работы!