
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общие сведения о комплексных соединениях
|
|
|
|
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Соединения, образованные из двух или более простых соединений, каждое из которых может существовать независимо, называют комплексными соединениями. Иногда, чтобы подчеркнуть особенность образования химической связи в этих соединениях, их определяют как соединения высшего порядка, образованные из более простых, устойчивых соединений без возникновения новых электронных пар.
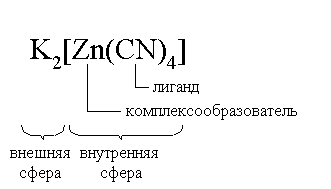 Центральный ион (атом) в комплексном соединении называется комплексообразователем. Это обычно ион d- или f-элемента, реже – р- или s-элемента. Непосредственно окружающие комплексообразователь ионы или молекулы, называемые лигандами, образуют вместе с комплексообразователем так называемую внутреннюю (координационную) сферу комплексного соединения. Ее обычно выделяют квадратными скобками. Ионы (молекулы) за пределами внутренней сферы образуют внешнюю сферу комплексного соединения. Например, в соединении
Центральный ион (атом) в комплексном соединении называется комплексообразователем. Это обычно ион d- или f-элемента, реже – р- или s-элемента. Непосредственно окружающие комплексообразователь ионы или молекулы, называемые лигандами, образуют вместе с комплексообразователем так называемую внутреннюю (координационную) сферу комплексного соединения. Ее обычно выделяют квадратными скобками. Ионы (молекулы) за пределами внутренней сферы образуют внешнюю сферу комплексного соединения. Например, в соединении
Общее число лигандов во внутренней сфере называется координационным числом (к.ч.). Простейшее объяснение механизма образования химической связи в комплексных соединениях – донорно-акцепторное взаимодействие между лигандами и комплексообразователем: лиганды поставляют свободные электронные пары на пустые d-ор6итали комплексообразователя (подробнее – во второй части этого пособия). Лиганд в общем случае может занимать во внутренней сфере не одно, а два (или более) координационных мест в соответствии с числом свободных электронных пар, поставляемых лигандом на свободные орбитали комплексообразователя. Число таких координационных мест, занимаемых лигандом, называется дентатностью. Соответственно различают: монодентатные лиганды – F─, Cl─, CN─, ОН─, NH3, H2O и т.д.; бидентатные лиганды – С2О42─, этилендиамин и т.п. Возможны лиганды и большей дентатности, так, в аналитической химии широко применяется этилендиаминтетрауксусная кислота и ее динатриевая соль (ЭДТА), эти лиганды имеют дентатность, равную шести. Координационные числа обычно четные, наиболее распространены к.ч. 6 и 4. Как правило, координационное число равно удвоенной степени окисления иона-комплексообразователя, то есть комплексным соединениям Ме2+ наиболее характерно к.ч.=4, а для комплексов Ме3+ к.ч.=6. Однако следует иметь в виду, что координационные числа часто бывают и больше, чем удвоенная степень окисления иона-комплексообразователя, и, гораздо реже, меньше. Так, в водных растворах большинство ионов двухвалентных металлов представляют собой гексаакваионы [Me(H2O)6]2+.
По характеру лигандов можно выделить следующие основные типы комплексных соединений. В аквакомплексах лигандом является молекула воды, например, кристаллогидраты. В гидроксокомплексах лиганд – ОН─,
например: K2[Sn(OH)4], Na3[Cr(OH)6]. Аммиачные комплексы (лиганд – NH3), например: [Ag(NH3)2]Cl, [Cu(NH3)4](OH)2. Наиболее обширную группу составляют ацидокомплексы, в которых лигандами выступают анионы кислотных остатков, например: K[Au(CN)2], K2[HgI4].
Все приведенные выше комплексные соединения являются однородными, то есть содержат единственный лиганд; возможны и комплексные соединения с различными лигандами, например: [Cr(H2O)5Cl]Cl2.
Могут быть комплексные соединения и без внешней сферы, то есть внутрисферные комплексные соединения, например: [Pt(NH3)2Cl2].
Названия комплексных соединений строятся по принципу названий солей с указанием лигандов и степени окисления комплексообразователя. При построении названия комплексного катиона или аниона первоначально называют ионные лиганды в порядке возрастания степени их сложности. Далее называют лиганды-молекулы также в порядке возрастания степени их сложности. При этом молекулы H2O и NH3 обозначаются "аква" и "аммин". При необходимости используются соответствующие соединительные гласные. В конце названия комплексного катиона или аниона называется ион-комплексообразователь с указанием его степени окисления римскими цифрами в скобках. В случае аниона берется корень латинского названия элемента, к нему прибавляется окончание "ат", например: станнат, аурат, плюмбат. Примеры:
[Cr(NH3)4Cl2]Cl хлорид дихлоротетрамминхрома (III);
K3[Al(OH)6] гексагидроксоалюминат (III) калия;
[Co(NH3)6][Cr(CN)6] гексацианохромат (III) гексаамминкобальта (III);
[Pt(NH3)2Cl2] дихлородиамминплатина (II).
Для комплексных соединений характерно явление изомерии, рассмотрим кратко основные его типы. Ионизационная изомерия обусловлена различным распределением ионов между внутренней и внешней сферами комплексного соединения, например:
[Cr(NH3)4Cl2]Br и [Cr(NH3)4ClBr]Cl.
В случае если катион и анион являются комплексными, возможна координационная изомерия, она связана с различным распределением лигандов между комплексообразователями, например:
[Cr(NH3)6][Co(CN)6] и [Co(NH3)6][Cr(CN)6].
Если молекулы или ионы, являющиеся лигандами, могут существовать в различных изомерных формах, возможна изомерия лигандов. Такой вид изомерии чаще характерен для комплексных соединений с органическими лигандами, например:

Различное пространственное расположение лигандов ведет к цис-транс-изомерии и зеркальной изомерии. Так для комплексов с к.ч.=4, имеющих квадратное строение, существуют цис- и транс-изомеры, например:

цис-изомер транс-изомер
Зеркальные изомеры комплексных соединений имеют идентичные химические и физические свойства, они различаются лишь асимметрией кристаллов и разным направлением вращения плоскости поляризации света.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2892; Нарушение авторских прав?; Мы поможем в написании вашей работы!