
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз солей. Пример 1. Определить рН 0,3 М раствора NH4Br, если константа диссоциации гидроксида аммония в водном растворе составляет 1,71×10–5
|
|
|
|
Пример 1. Определить рН 0,3 М раствора NH4Br, если константа диссоциации гидроксида аммония в водном растворе составляет 1,71×10–5.
Решение. Бромид аммония гидролизован по катиону в растворе:
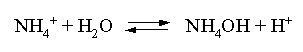
Согласно соотношению (3.23):
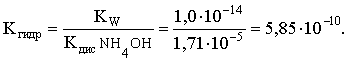
С другой стороны (соотношение 3.24):
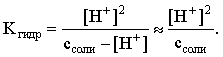
Из этих двух выражений и вычисляем рН 0,3 М раствора NH4Br:
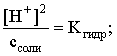
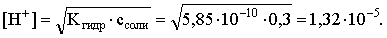
pH = – lg 1,32×10–5 = 4,88.
Пример 2. Определить рН раствора и степень гидролиза соли в 0,1 М растворе Na2S, если константы ступенчатой диссоциации H2S составляют: К1=9,74×10–8; К2= 1,36×10–13.
Решение. Сульфид натрия – соль, гидролизованная по аниону. Поскольку сероводородная кислота двухосновна, гидролиз идет по двум ступеням. Выше было показано, что для практических расчетов достаточно принимать во внимание лишь первую ступень гидролиза. В нашем случае это следующий процесс:
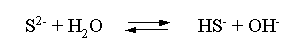
Определяем константу гидролиза:
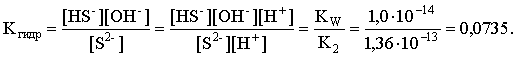
С другой стороны:
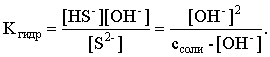
Решая полученное квадратное уравнение, находим рН раствора и степень гидролиза:
[ОН–] = 0,0565 (второй корень уравнения отрицателен!)
рОН = – lg 0,0565 = 1,25; рН = 14 – 1,25 = 12,75;
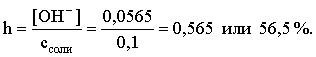
Пример 3. рН 0,5 М раствора ацетата калия равен 9,23. Определить константу диссоциации уксусной кислоты.
Решение. Ацетат калия – соль, гидролизованная по аниону:
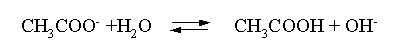
Согласно соотношению (3.27) для этой системы:
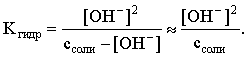
Находим величину константы гидролиза:
pH = 9,23; pOH = 14 – 9,23 = 4,77; [OH–] = 1,70×10–5;
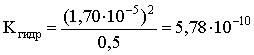 .
.
С другой стороны, согласно (3.26) в случае гидролиза по аниону:
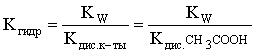 .
.
Отсюда определяем константу диссоциации уксусной кислоты:
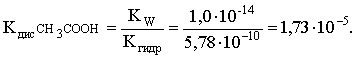
Пример 4. По справочным данным определить константу гидролиза НСООК при 298,15 К.
Решение. Формиат калия – соль, подвергающаяся гидролизу по аниону:
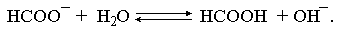
Константа равновесия этого процесса и есть константа гидролиза, она соответственно может быть найдена на основе стандартного значения энергии Гиббса:
DG0 = DG0обрOH–(р-р, ст.с) + DG0обрHCOOH(р-р, ст.с., гип.недис) – DG0обрH2O(ж) –
–DG0обрHCOO–(р-р, ст.с) = –157,3 + (–373,0) – (–237,3) – (–351,5) = 58,5 кДж.
Далее находим константу гидролиза:
DG0 = – RT ln Kгидр;
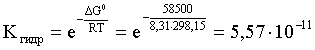 .
.
Пример 5. На сколько единиц изменится рН раствора соли, гидролизованной по аниону, при его разбавлении в 100 раз?
Решение. В случае гидролиза по аниону согласно (3.27):
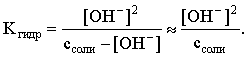
Запишем равенство величин констант гидролиза в растворах соли двух концентраций:
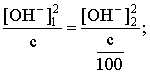
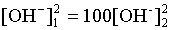 .
.
Логарифмируем полученное соотношение и меняем знаки в уравнении:
2 lg [OH–]1 = 2 + 2 lg [OH–]2
– lg [OH–]1 = –1 – lg [OH–]2
pOH1 = pOH2 – 1
14 – pH1 = 14 – pH2 – 1
pH1 = pH2 + 1.
Таким образом, при разбавлении раствора соли, гидролизованной по аниону, в 100 раз, величина рН уменьшается на единицу.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 7817; Нарушение авторских прав?; Мы поможем в написании вашей работы!