
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Образование и разрушение комплексных соединений. Диссоциация комплексных соединений. Пример 1. Константа нестойкости комплексного иона [Zn(CN)4]2– равна 2,5×10–20
|
|
|
|
Задачи и упражнения
Задачи и упражнения
Пример 1. Константа нестойкости комплексного иона [Zn(CN)4]2– равна 2,5×10–20. Определить концентрацию иона Zn2+ в 0,1 М растворе K2[Zn(CN)4], содержащем избыток KCN в количестве 1 моль/л.
Решение. Диссоциация фигурирующих в задаче электролитов описывается следующим образом:
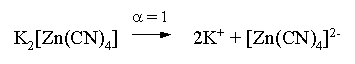
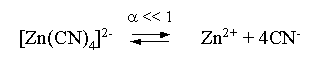

Константа равновесия диссоциации комплексного иона – константа нестойкости. Пусть равновесная концентрация иона Zn2+ составляет Х моль/л, концентрации остальных ионов составят: [CN–] = 4X+1; [Zn(CN)4]2– = 0,1 – Х.
Подставляем эти значения в выражение для константы нестойкости и находим искомую величину:

X = [Zn2+] = 2,5×10–21.
Пример 2. При какой концентрации ионов S2– начнет выпадать осадок CdS из 0,1 М раствора K2[Cd(CN)4], содержащего избыток KCN в количестве
1 моль/л? Kнест. [Cd(CN)4]2– = 1,4×10–19; ПРZnS = 1,2×10–28.
Решение. Условием выпадения осадка является превышение значения ПК над величиной ПР. Повторяя выкладки предыдущей задачи, находим равновесную концентрацию иона Cd2+:
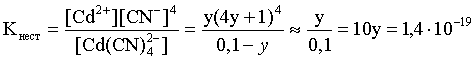
y = 1,4×10–20.
Наконец, определяем концентрацию иона S2– :
ПК > ПР; [Cd2+][S2–] > ПР;
 .
.
Пример З. На основе справочных данных вычислить при 298,15 К константу устойчивости комплексного иона [Zn(OH)4]2–.
Решение. Константа устойчивости иона [Zn(OH)4]2– – это константа равновесия процесса
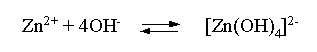
и она, естественно, может быть найдена через значение DG0 для написанного процесса:
DG0 = DG0 обр [Zn(OH)4]2– (р-р, ст.с.,гип.недис) – DG0 обр Zn2+ (р-р, ст.с) –
– 4 DG0 обр OH– (р-р, ст.с).
Выписываем из справочника необходимые величины и находим значение DG0 процесса, а затем – и константу устойчивости:
DG0 = – 860,8 – (–147,2) – 4(–157,3) = – 84,4 кДж;
DG0 = – RT ln Kуст;
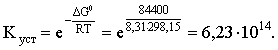
Пример 4. Определить, какова должна быть концентрация избыточного аммиака в 0,5 М растворе [Ag(NH3)2]Cl, чтобы введение 0,0001 моль KBr
в 1 л такого раствора не приводило к образованию осадка AgBr. При решении считать, что введение 0,0001 моль KBr в 1 л раствора комплексного соединения не изменит объем раствора.
Kнест [Ag(NH3)2]+ = 5,6×10–8; ПР AgBr = 4,9×10–13.
Решение. Для того чтобы осадок не выпадал, необходимо выполнение условия:
ПК = [Ag+][Br–] £ ПР = 4,9×10–13.
Концентрация бромидных ионов в окончательном растворе известна:
[Br–] = [KBr] = 10–4 моль/л.
Находим критическую концентрацию ионов серебра в растворе:
[Ag+] 10–4 £ 4,9×10–13; [Ag+] £ 4,9×10–9 .
Таким образом, задача сводится к определению концентрации избыточного аммиака, позволяющей поддерживать равновесную концентрацию ионов серебра меньше, чем 4,9×10–9 моль/л. Пусть искомая величина составляет Y моль/л. В соответствии с уравнением диссоциации комплексного соединения
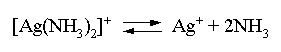
равновесные концентрации ионов составят:
[Ag+] = 4,9×10–9; [NH3] = 2×4,9×10–9 +Y; [Ag(NH3)2]+ = 0,5 – 4,9×10–9 .
Подставляем эти величины в выражение для константы нестойкости комплексного иона и находим нужное значение:
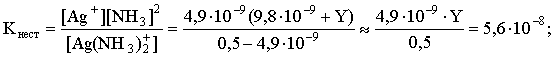
Y = 5,7.
Следовательно, при концентрации аммиака, большей 5,7 моль/л, введение в 1 л 0,5 М раствора [Ag(NH3)2]Cl 0,0001 моль КBr не будет приводить
к выпадению осадка бромида серебра.
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 7990; Нарушение авторских прав?; Мы поможем в написании вашей работы!