
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительные реакции
|
|
|
|
Степенью окисления атома элемента в соединении называется условный заряд, вычисляемый по определенным правилам с учетом электроотрицательности атомов и смещения электронной плотности при образовании химической связи. В дальнейшем степень окисления атома будем указывать по системе знак-число, а заряд иона – по системе число-знак.
Правила вычисления степеней окисления:
1) степень окисления атома фтора в любых соединениях всегда -1,
2) степени окисления атомов щелочных металлов в соединениях всегда +1,
3) степень окисления атома водорода в соединениях +1, а в гидридах металлов она равна -1, например: LiH, CaH2;
4) степень окисления атома кислорода обычно равна -2, кроме пероксидов (Na2O2–1), надпероксидов (KO2–1/2), озонидов (KO3–1/3) и соединений кислорода со фтором, где атомы кислорода имеют положительные степени окисления;
5) алгебраическая сумма степеней окисления всех атомов в молекуле равна нулю, а в ионе – заряду иона.
Порядок "старшинства" названных правил возрастает с уменьшением указанного номера правила.
Химические реакции, в которых происходит изменение степеней окисления атомов в молекулах, называются окислительно-восстановитель-ными реакциями (ОВР). Вещества, молекулы которых принимают электроны, называются окислителями. В химической реакции такие вещества восстанавливаются. Вещества, молекулы которых отдают электроны, называются восстановителями. В течение реакции такие вещества окисляются.
Типичными окислителями являются:
1) вещества, молекулы которых содержат атомы элементов в высших положительных степенях окисления, например: KMn+7O4, KBi+5O3, K2Cr+62O7, Pb+4O2;
2) катионы металлов более высокого заряда (более высокой степени окисления), например: Fe3+, Au3+, Sn4+;
3) галогены и кислород (при повышенных температурах).
Типичными восстановителями являются:
1) вещества, молекулы которых содержат атомы элементов в высоких отрицательных степенях окисления или степени окисления которых легко повышаются, например: Na2S–2, KI–1, N–3H3, KN+3O2, K2S+4O3;
2) катионы металлов более низкой степени окисления, например: Fe2+, Sn2+;
3) металлы, из них в первую очередь – щелочные и щелочно-земельные металлы, а также – водород при повышенных температурах.
Обычно различают следующие основные типы ОВР:
1) межмолекулярные ОВР – в этих реакциях окислителем и восстановителем являются разные молекулы, например:
2KMn+7O4 + 10KI–1 + 8H2SO4 = 2Mn+2SO4 + 6K2SO4 + 5I2 + 8H2O
Mn+7 + 5ē = Mn+2 | 2 (окислитель)
2I– – 2ē = I2 | 5 (восстановитель)

2O–1 + 2ē = 2O–2 | 1 (окислитель)
2I– – 2ē = I2 | 1 (восстановитель)
2) внутримолекулярные ОВР – в этих реакциях окислителем и восстановителем являются атомы различных или одинаковых элементов, находящихся в разных частях одной молекулы, например:
t
(N–3H4)2Cr+62O7 = N02 + Cr+32O3 + 4H2O
2N–3 – 6ē =  | 1 (восстановитель)
| 1 (восстановитель)
2Cr6+ + 6ē = 2Cr3+ | 1 (окислитель)
250oC
N–3H4N+5O3 = N+12O + 2H2O
N+5 + 4ē = N+1 | 1 (окислитель)
N–3 – 4ē = N+1 | 1 (восстановитель)
3) реакции диспропорционирования, в которых окислителем и восстановителем являются одни и те же атомы в молекуле, например:
t
3Cl02 + 6KOH = 5KCl–1 + KCl+5O3 + 3H2O
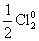 + ē = Cl– | 5
+ ē = Cl– | 5
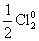 – 5ē = Cl+5 | 1
– 5ē = Cl+5 | 1
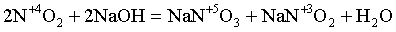
N+4 + ē = N+3 | 1
N+4 – ē = N+5 | 1
Рассмотрим поведение наиболее распространенных окислителей и восстановителей в ОВР.
Азотная кислота, являясь окислителем, восстанавливается обычно до оксидов азота  ,
, ,
, ,
, или, в случае сильных восстановителей – до
или, в случае сильных восстановителей – до  или иона аммония N-3H4+. Отметим, что образование N2O3 происходит редко и этот случай можно не рассматривать.
или иона аммония N-3H4+. Отметим, что образование N2O3 происходит редко и этот случай можно не рассматривать.
Глубина восстановления N+5 из азотной кислоты одинаковой концентрации возрастает с увеличением силы восстановителя. При одном и том же восстановителе глубина ее восстановления увеличивается с уменьшением концентрации кислоты. Иллюстрируем эти закономерности на примерах взаимодействия азотной кислоты с металлами.
При этом полезно помнить, что взаимодействие меди с азотной кислотой различной концентрации описывается уравнениями:
Cu0 + 4HN+5O3 (конц) = Cu+2(NO3)2 + 2N+4O2 + 2H2O
Cu0 – 2ē = Cu+2 | 1
N+5 + ē = N+4 | 2
3Cu0 + 8HN+5O3 (разб) = 3Cu+2(NO3)2 + 2N+2O + 4H2O
Cu0 – 2ē = Cu+2 | 3
N+5 + 3ē = N+2 | 2
Разумеется, эти и последующие уравнения реакций различных веществ с азотной кислотой по составу продуктов соответствуют начальной стадии процессов, по мере их протекания и уменьшения концентрации кислоты-окислителя неизбежно меняется состав продуктов восстановления HNO3.
Продукты же восстановления азотной кислоты другими металлами будут определяться положением этих металлов в ряду активности по отношению к меди или, говоря более строго, величинами стандартных электродных потенциалов. Так, например, при взаимодействии с Cu, Zn, Mg и К состав продуктов восстановления кислоты будет примерно следующим:
Cu NO2
HNO3 (конц) + Zn ® NO (N2O)
Mg N2O (N2)
K N2 (NH4+)
Cu NO
HNO3 (разб) + Zn ® N2O (N2)
Mg N2 (NH4+)
K NH4+
С неметаллами реально взаимодействует лишь концентрированная азотная кислота, которая при этом, как правило, восстанавливается до NO2 или до NO. При этом неметалл окисляется до высшей положительной степени окисления в форме кислоты, если она устойчива, или в форме оксида, если кислота неустойчива, например:
P4 H3P+5O4
HNO3 (конц) + S ® H2S+6O4
C C+4O2
B H3B+3O3
Окислительное действие перманганата калия в зависимости от кислотности среды описывается следующей схемой:
® +5ē, H+ ® Mn+2 (MnSO4)
KMnO4 ® +3ē, H2O ® Mn+4 (MnO2)
® +ē, OH– ® Mn+6 (K2MnO4)
Перманганат калия является сравнительно сильным окислителем в кислой среде, окислителем средней силы – в нейтральной среде, в щелочной среде представляет собой относительно слабый окислитель. Примеры ОВР с участием КМnO4:
2KMn+7O4 + 5KN+3O2 + 3H2SO4 = 2Mn+2SO4 + 5KN+5O3 + K2SO4 + 3H2O
Mn+7 + 5ē = Mn+2 | 2
N+3 – 2ē = N+5 | 5
3KMn+7O4 + 3C–2H3OH  3HC0HO + 2Mn+4O2 + 2KOH + 2H2O
3HC0HO + 2Mn+4O2 + 2KOH + 2H2O
Mn+7 + 3ē = Mn+4 | 2
C–2 – 2ē = C0 | 3
2KMn+7O4 + 2KI–1  2K2Mn+6O4 + I20
2K2Mn+6O4 + I20
Mn+7 + ē = Mn+6 | 2
2I–1 – 2ē = I20 | 1
Обратим внимание, что в двух последних случаях вода и едкое кали не являются непосредственными участниками ОВР, однако они должны быть указаны над равенством, чтобы показать, в какой среде протекает химическая реакция. Отметим также, что приведенная выше схема восстановления КМnO4 отражает одновременно и наиболее стабильные в той или иной среде формы соединений.
Серная кислота в разбавленном растворе является окислителем за счет ионов Н+, в концентрированном, горячем растворе (более 50 мас. % H2SO4) серная кислота представляет собой сравнительно сильный окислитель, при этом в качестве окислителя выступает S+6. В случае слабых восстановителей S+6 восстанавливается до S+4, как правило, в виде SO2, например:
2H2S+6O4 (конц) + Cu0 = Cu+2SO4 + S+4O2 + 2H2O
Cu0 – 2ē = Cu+2 | 1
S+6 + 2ē = S+4 | 1
2H2S+6O4 (конц) + S0 = 3S+4O2 + 2H2O
S+6 + 2ē = S+4 | 2
S0 – 4ē = S+4 | 1
2H2SO4 (конц) + 2KBr (кр) = K2SO4 + Br2 +SO2 + 2H2O
S+6 + 2ē = S+4 | 1
2Br– – 2ē = Br20 | 1
При наличии сильного восстановителя восстановление S+6 идет более глубоко – до S0 или даже до Н2S–2, например:
4H2S+6O4 (конц) + 6KI–1 (кр) = S0 +3I20 + 3K2SO4 + 4H2O
S+6 + 6ē = S0 | 1
2I– – 2ē = I20 | 3
5H2SO4 (конц) + Mg0 = 4Mg+2SO4 + H2S-2 + 4H2O
S+6 + 8ē = S–2 | 1
Mg0 – 2ē = Mg+2 | 4
Широко распространенным и удобным окислителем является кислый раствор бихромата калия, Cr+6 в этом соединении восстанавливается до Cr+3 в форме солей:
K2Cr+62O7 + 3KN+3O2 + 4H2SO4 = Cr+32(SO4)3 + 3KN+5O3 + K2SO4 + 4H2O
2Cr+6 + 6ē = 2Cr+3 | 1
N+3 – 2ē = N+5 | 3
K2Cr+62O7+3C-1H3C-1HO+4H2SO4 = Cr+32(SO4)3 + 3C0H3C0OOH+K2SO4+4H2O
2Cr+6 + 6ē = 2Cr+3 | 1
2C–1 – 2ē = 2C0 | 3
В щелочной среде бихроматы быстро переходят в хроматы в соответствии с уравнением:
Cr2O72– + 2OH– = 2CrO42– + H2O,
а в кислой среде, наоборот, хроматы легко переходят в бихроматы:
2CrO42– + 2H+ = Cr2O72– + H2O.
Это обстоятельство следует учитывать при написании уравнений реакций с участием соединений Cr+6. Обратим внимание, что соединения Cr+6 в качестве окислителей целесообразно использовать лишь в кислой среде, в щелочной среде они представляют собой крайне слабые окислители; эти обстоятельства достаточно красноречиво иллюстрируются соответствующими величинами стандартных электродных потенциалов:
Cr2O72- + 14H+ + 6ē = 2Cr+3 + 7H2O, E0 = 1,33 B
CrO42- + 4H2O + 3ē = Cr(OH)3 + 5OH–, E0 = –0,13 B
Поскольку в молекуле пероксида водорода атомы кислорода имеют промежуточную степень окисления (-1), то молекулы этого соединения могут быть как окислителями, так и восстановителями. Обычно в качестве окислителя используют водные растворы с концентрацией этого соединения более 10–15 мас.%, а разбавленные растворы (1–5 мас.% H2O2) – применяют в качестве восстановителя:
H2O2–1 + 2KI–1 + H2SO4 = I20 +2H2O–2 + K2SO4
2O–1 + 2ē = 2O–2 | 1
2I–1 – 2ē = I20 | 1
5H2O2–1 + 2KMn+7O4 + 3H2SO4 = 2Mn+2SO4 + K2SO4 + 5O20 + 8H2O
2O–1 + 2ē = O20 | 5
Mn+7 + 5ē = Mn+2 | 2
Хлорная и бромная вода представляют собой разбавленные растворы соответствующих галогенов (растворимость Cl2 и Br2 невелика): окисляя какие-либо соединения, галогены восстанавливаются до анионов Г –1:
Cl20 + 2ē = 2Cl–1 Br20 + 2ē = 2Br–1
Наиболее распространенными в лабораторной практике являются следующие восстановители: нитриты (например KN+3O2), сульфиды (K2S–2), сульфиты (K2S+4O3), иодиды (KI–1), гипофосфиты (KH2P+1O2), фосфиты (K2HP+3O3), соединения олова (II) (SnCl2), железа (II) (FeSO4), магний, алюминий, цинк. В реакциях окисления-восстановления указанные вещества окисляются, как правило, по следующим схемам:
N+3O2– – 2ē ® N+5O3–
S–2 – 2ē = S0
S+4O32– – 2ē ® S+6O42–
2I–1 – 2ē = I20
H2P+1O2– – 2ē ® H2P+3O3– или
H2P+1O2– – 4ē ® H2P+5O4–
Sn+2 – 2ē = Sn+4
Fe2+ – ē = Fe3+
Металлы окисляются до соответствующих катионов. Полезно помнить, что в случае амфотерных металлов в разбавленных водных растворах при наличии избытка щелочи формой существования соединений будут, как правило, гидроксокомплексы, например: K3[Al(OH)6], Na2[Zn(OH)4].
В неорганической химии существуют своеобразные универсальные окислитель и восстановитель – так называемые "щелочной плав" и "водород
в момент выделения". Первый представляет собой композицию из кристаллического соединения, разлагающегося при нагревании с выделением кислорода (например К2O2, KNO3, KClO3 и т.п.) и щелочного компонента. "Щелочной плав" в большинстве случаев окисляет атомы элементов соответствующих соединений до высших положительных или близких к ним степеней окисления, например:
3KN+5O3 + W + 2KOH 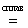 3KN+3O2 + K2W+6O4 + H2O
3KN+3O2 + K2W+6O4 + H2O
N+5 + 2ē = N+3 | 3
W0 – 6ē = W+6 | 1
KCl+5O3 + 3Mn+4O2 + 6KOH 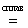 KCl–1 + 3K2Mn+6O4 + 3H2O
KCl–1 + 3K2Mn+6O4 + 3H2O
Mn+4 – 2ē = Mn+6 | 3
Cl+5 + 6ē = Cl–1 | 1
Действующим началом "щелочного плава" является атомарный (молекулярный) кислород, получающийся при разложении соответствующего соединения.
Реакция между кусочками металла, погруженного в минеральную кислоту, и раствором или кусочками амфотерного металла, находящегося в растворе щелочи, идет на поверхности металла. Именно там восстанавливаются протоны и образуются атомы (молекулы) водорода. Если в такой системе находится соединение, способное восстанавливаться, то оно и будет восстановлено до высшей отрицательной или близкой к ней степени окисления атома (атомов) элемента. Катионы металлов будут восстанавливаться в этих условиях до минимальной положительной степени окисления. Описанная восстановительная система и представляет собой "водород в момент выделения". Пример:
3Zn0 + 9HCl + Na3As+3O3 = As–3H3 + 3Zn+2Cl2 + 3NaCl + 3H2O
Zn0 – 2ē = Zn+2 | 3
As+3 + 6ē = As–3 | 1
И "щелочной плав", и "водород в момент выделения" активно используются при проведении ОВР, первый особенно удобен при переведении металлов, не растворяющихся в обычных минеральных кислотах, в растворимые соли; второй – эффективен при получении водородных соединений неметаллов. Разумеется, не следует забывать, что абсолютным окислителем является электрический ток на аноде, а абсолютный восстановитель – электрический ток на катоде.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2130; Нарушение авторских прав?; Мы поможем в написании вашей работы!