
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Эквивалент. Закон эквивалентов
|
|
|
|
Задачи и упражнения
Пример 1. При взаимодействии 3,49 г металла с избытком разбавленной серной кислоты выделилось 1,68 л (н.у.) газа. Определить молярную массу эквивалента металла и его оксида.
Решение. В соответствии с законом эквивалентов (соотношение 6.3) для процесса

nэкв Me = nэкв H2
Поскольку fэкв Н2 = 0,5, то 1 моль эквивалентов водорода при н.у. занимает объем 0,5×22,4 = 11,2 л. Находим число молей эквивалентов участников реакции:
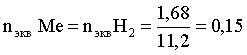 моль экв.
моль экв.
Наконец, определяем молярную массу эквивалента металла:
 ,
,  г/(моль экв).
г/(моль экв).
Молярная масса эквивалента оксида составит соответственно
23,3 + 8 = 31,3 г/(моль экв).
Пример 2. Сколько литров (н.у.) сероводорода может быть окислено 0,316 г перманганата калия в кислой среде? Сколько граммов серы при этом будет получено?
Решение. Схема протекающего процесса:
KMn+7O4 + H2S–2 + H+ = Mn+2 + S0 +....
По закону эквивалентов:
nэкв KMnO4 = nэкв H2S = nэкв S.
Эту величину находим по перманганату калия:
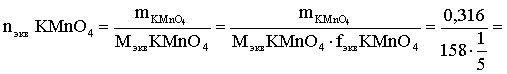
= 0,01моль экв.
Далее определяем массу серы:
 mS = 0,16 г.
mS = 0,16 г.
Объем 1 моль эквивалентов сероводорода (н.у.) составит
22,4 × fэкв H2S = 22,4 × 0,5 = 11,2 л.
Отсюда вычисляем объем газа:
VH2S = n экв H2S × Vэкв = 0,01 × 11,2 = 0,112 л.
Пример 3. На нейтрализацию 0,164 г кислоты израсходовано 40 мл 0,1 М раствора NaOH. Найти молярную массу эквивалента кислоты.
Решение. По закону эквивалентов:
nэкв NaOH = nэкв к-ты
Фактор эквивалентности NaOH в любых обменных реакциях составляет единицу, следовательно, для NaOH молярность и нормальность раствора совпадают. Тогда число молей эквивалентов едкого натра составит 0,04×0,1=0,004 моль экв. Это значение позволяет определить молярную массу эквивалента кислоты:
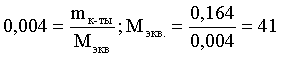 г.
г.
Пример 4. Какой объем 0,1 М раствора К2Cr2O7 потребуется для окисления в кислой среде 200 мл 0,1 М раствора нитрита калия?
Решение. Схема протекающего процесса:
K2Cr+62O7 + KN+3O2 + H+ ® Cr+3 + KN+5O3 + …

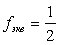
Воспользуемся законом эквивалентов в варианте соотношения (6.4):
 .
.
Нормальности растворов составят:
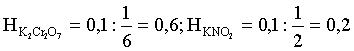 .
.
Находим неизвестный объем:

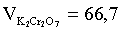 мл.
мл.
Пример 5. Каким объемом 0,05 М раствора KMnO4 можно заменить 1 л 10 мас.% раствора K2Cr2O7 плотностью 1,08 г/мл в реакциях окисления-восстановления, протекающих в кислой среде?
Решение. По закону эквивалентов:
nэкв KMnO4 = nэкв K2Cr2O7
 .
.
Задача фактически сводится к нахождению молярной, а затем – нормальной концентрации раствора K2Cr2O7. Первоначально находим молярную концентрацию:
 ;
;  г/моль.
г/моль.
Далее, учитывая процессы, происходящие при окислении перманганатом и бихроматом калия в кислой среде
Mn+7O4– + 8H+ + 5 ē = Mn2+ + 4 H2O,
Cr+62O7 + 14H+ + 6 ē = 2Cr3+ + 7 H2O,
производим необходимые вычисления и определяем требуемый объем:
 ;
; 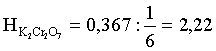 ;
;
 ,
, 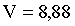 л.
л.
ПРИЛОЖЕНИЕ
Таблица 1
Стандартные термодинамические характеристики образования индивидуальных веществ, водных растворов и ионов при 298,15 К
| Вещество и состояние | DНобр, кДж/моль | DGобр, кДж/моль | S°, Дж/(моль×К) |
| Ag+ (p-p, ст. с) | 105,6 | 77,13 | 72,6 |
| [Ag(NH3)2]+(p-р, ст.с., гип.недис) | -117,2 | -17,6 | |
| AgBr (к) | -100,7 | -97,2 | 107,1 |
| Ag2S (к) | -32,8 | -40,8 | 144,0 |
| Аl (к) | 28,3 | ||
| Аl2O3 (к) | -1675,7 | -1582,3 | 50,9 |
| А12O3 (аморф) | -1602 | ¾ | ¾ |
| Ва2+ (p-p, ст.с) | -524,0 | -546,8 | 8,4 |
| BaSO4 (к) | -1458,9 | -1347,9 | 132,2 |
| Вr2 (г) | 30,9 | 3,1 | 245,4 |
| Вr2 (ж) | 152,2 | ||
| Вr– (p-p, ст.с) | -121,4 | -104,1 | 83,3 |
| С (г) | 715,1 | 669,7 | 158,0 |
| C (к, графит) | 5,74 | ||
| СН4 (г) | -74,8 | -50,8 | 186,3 |
| CN– (p-p, ст.с) | 150,6 | 171,6 | 96,4 |
| СO (г) | -110,5 | -137,1 | 197,5 |
| СO2 (г) | -393,5 | -394,4 | 213,7 |
| СО32- (р-р, ст.с) | -676,6 | -527,6 | -56 |
| С2Н6 (г) | -84,7 | -33,0 | 229,5 |
Продолжение табл. 1
| С6Н6 (ж) | 49,0 | 124,5 | 172,8 |
| HCN (р-р, ст.с., гип.недис) | 107,3 | 119,0 | 127,3 |
| СООН– (р-р, ст.с) | -426,2 | -351,5 | |
| НСООН (р-р, ст.с., гип.недис) | -426,0 | -373,0 | |
| НСО3– (р-р, ст.с., гип.недис) | -691,3 | -586,6 | |
| Н2СО3 (р-р, ст.с., гип.недис) | -699,0 | -623,3 | |
| Са2+ (р-р, ст.с) | -543,1 | -552,8 | 56,5 |
| СаСО3 (к) | -1206,8 | - 1128,4 | 91,7 |
| CaF2 (к) | -1220,9 | -1168,5 | 68,5 |
| СаО (к) | -635,1 | -603,5 | 38,1 |
| Cd (к) | 51,8 | ||
| Cd2+ (р-р, ст.с) | -75,3 | -77,7 | -71 |
| CdS (к) | -157 | -153 | |
| Cl2 (г) | 223,0 | ||
| Сl– (р-р, ст.с) | -167,1 | 131,3 | -56,5 |
| Сl (г) | 121,3 | 105,3 | 165,1 |
| НСl (г) | -92,3 | -95,3 | 186,8 |
| Сr (к) | 23,6 | ||
| Сr2O3 (к) | -1140,6 | -1059,0 | 81,2 |
| F– (р-р, ст.с) | -331,5 | -277,7 | -13,8 |
| Fe2+ (р-р, ст.с) | -87,1 | -78,9 | -131 |
| Fе3+ (р-р, ст.с) | -46,4 | -4,5 | -309 |
| Fе(ОН)3 (к) | -827 | -700 | |
| H2 (г) | 130,5 | ||
| Н (г) | 218,0 | 203,3 | 114,6 |
| Н+ (р-р, ст.с) |
Продолжение табл. 1
| I2 (к) | |||
| I– (р-р, ст.с) | -55,2 | -51,7 | |
| I2 (р-р, ст.с) | |||
| К (к) | 64,7 | ||
| К+ (р-р, ст.с) | -252,3 | -282,5 | |
| КС1 (к) | -436,6 | -408,6 | 82,6 |
| КСlO3 (к) | -389,1 | -287,5 | 143,0 |
| К2Сr2O7 (к) | -206,2 | -1882 | |
| Mg (к) | 32,7 | ||
| Mg2+ (р-р, ст.с) | -468,1 | -457,3 | -134 |
| MgO (к) | -601,5 | -569,3 | 27,1 |
| Mg(OH)2 (к) | -924,7 | -833,7 | 63,2 |
| N (г) | 472,7 | 455,6 | 153,2 |
| N2 (г) | 191,5 | ||
| NН3 (г) | -46,2 | -132,3 | -16,7 |
| NH4 (р-р, ст.с) | -79,5 | 192,6 | -114 |
| NH4C1 (к) | -314,2 | -203,2 | 95,8 |
| NН4ОН (р-р, ст.с., гип.недис) | -366,2 | -264,0 | 181,7 |
| NO2 (г) | 33,5 | 51,6 | 240,2 |
| N2O4 (г) | 9,6 | 98,4 | 303,8 |
| Na (к) | 51,3 | ||
| Na+ (p-p, ст.с) | -240,4 | 262,1 | 58,9 |
| NaH (к) | -56,4 | -33,6 | 40,0 |
| NаНСО3 (к) | -949,1 | -851,1 | 101,3 |
| NaOH (к) | -495,9 | -379,8 | 64,4 |
Окончание табл. 1
| Nа2СО3 (к) | -1129,4 | -1045,7 | 135,0 |
| O2 (г) | 205,0 | ||
| ОН– (p-p, ст.с) | -230,0 | -157,3 | -10,9 |
| Н2O (г) | -241,8 | -228,6 | 188,7 |
| Н2O (ж) | -285,8 | -237,3 | 70,1 |
| Р (к, белый) | 41,1 | ||
| Р (к, красный) | -17,4 | -11,9 | 22,8 |
| РO43– (p-p, ст.с) | -1272 | -1012,6 | |
| НРO42– (p-p, ст.с., гип.недис) | -1286,2 | -1083,2 | -34 |
| Н2РO4– (p-p, ст.с., гип.недис) | -1289,9 | -1124,3 | 91,6 |
| Н3РO4 (p-p, ст.с., гип.недис) | -1281,8 | -1136,5 | |
| Рb2+ (p-p, ст.с) | -0,9 | -24,4 | |
| PbI2 (к) | -178 | -176 | |
| S2– (р-р, ст.с) | 32,6 | 85,4 | -15 |
| HS– (p-p, ст.с., гип.недис) | -18 | ||
| H2S (p-p, ст.с., гип.недис) | -40 | -28 | |
| SO42– (p-p, ст.с) | -911,0 | -745,7 | |
| SiH4 (г) | 34,7 | 57,2 | 204,6 |
| Н2Те (г) | 99,7 | 85,2 | 228,8 |
| W (к) | 32,7 | ||
| WO3 (к) | -842,7 | -763,8 | |
| Zn2+ (p-p, ст.с) | -153,6 | -147,2 | -111 |
| Zn(NH3)42+ (p-p, ст.с., гип.недис) | -537,0 | -304,6 | |
| Zn(CN)42– (p-p, ст.с., гип.недис) | 332,1 | 427,2 | |
| Zn(OH)42– (p-p, ст.с., гип.недис) | ¾ | -860,8 | ¾ |
Таблица 2
Стандартные величины электродных потенциалов при 298,15 К
в водных растворах
| Система | Е0, В |
| Li+ + ē = Li | -3,045 |
| K+ + ē = К | -2,925 |
| Ca2+ + 2ē = Сa | -2,87 |
| Al3+ + 3ē = Аl | -1,66 |
| Zn2+ + 2ē = Zn | -0,763 |
| Tl+ + ē = Tl | -0,336 |
| Ni2+ + 2ē = Ni | -0,250 |
| CrO42– + 4H2O + 3ē = Cr(OH)3 + 5OH– | -0,13 |
H+ + ē = 
| 0,00 |
| Cu2+ + 2ē = Cu | 0,334 |
| I2 + 2ē = 2I– | 0,536 |
| MnO4– + ē = MnO42– | 0,564 |
| MnO4– + 2H2O +3ē = MnO2 + 4OH– | 0,60 |
| Ag+ + ē = Ag | 0,80 |
| Br2 (ж) + 2ē = 2Br– | 1,065 |
| O2 + 4H+ + 4ē = 2H2O | 1,229 |
| MnO2 + 4H+ + 2ē = Mn2+ + 2H2O | 1,23 |
| Tl3+ + 2ē = Tl+ | 1,25 |
| Cr2O72– + 14H+ + 6ē = 2Cr3+ + 7H2O | 1,33 |
| PbO2 + 4H+ + 2ē = Pb2+ + 2H2O | 1,455 |
| MnO4– + 8H+ + 5ē = Mn2+ + 4H2O | 1,51 |
BrO3 + 6H+ + 5ē =  +3H2O +3H2O
| 1,52 |
| H2O2 + 2H+ + 2ē = 2H2O | 1,77 |
| Co3+ + ē = Co2+ | 1,82 |
| S2O82– +2ē = 2SO42– | 2,01 |
| O3 + 2H+ + 2ē = O2 + H2O | 2,07 |
| F2 + 2ē = 2F– | 2,65 |
| F2 + 2H+ + 2ē = 2HF | 3,06 |
ЗАКЛЮЧЕНИЕ
В данном пособии изложена только часть материала, традиционно относящегося к курсу “Теоретические основы химии” и охватывающего вопросы теории химических процессов. Другая часть – электронное строение атомов, теория химической связи и строение молекул, межмолекулярное взаимодействие – составляет отдельную дисциплину, называемую “Строение вещества”, которая войдет в следующее учебное пособие.
Вместе две названные дисциплины составляют фундамент, на котором базируется изложение химии элементов и их соединений или неорганической химии. Конспект лекций по неорганической химии, содержащий упражнения и задачи, будет третьим, завершающим учебным пособием в серии, объединённой названием “Начала химии”.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1. Карапетьянц М.X. Введение в теорию химических процессов. М.: Высшая школа, 1975.
2. Карапетьянц М.X. Химическая термодинамика. М.: Госхимиздат, 1953.
3. Карапетьянц М.X., Дракин С.И. Общая и неорганическая химия. М.: Химия, 1992.
4. Коттон Ф., Уилкинсон Дж. Современная неорганическая химия. М.: Мир, 1970.
5. Некрасов Б.В. Основы общей химии. М.: Химия, Т.1. 1965; Т.2. 1967; Т.З. 1970.
6. Зайцев О.С. Химическая термодинамика к курсу общей химии. М.: Изд-во МГУ, 1973.
7. Зайцев О.С. Общая химия. Состояние веществ и химические реакции. М.: Химия, 1990.
8. Полинг Л. Общая химия. М.: Мир, 1974.
9. Реми Г. Курс неорганической химии. М.: Мир, Т.1. 1963; Т.2. 1966.
10. Полторак О.М. Химическая термодинамика и кинетика в курсе общей и неорганической химии. М.: Изд-во МГУ, 1973.
11. Хаускрофт К., Констебл Э. Современный курс общей химии. В 2-х т. Пер. с англ. М.: Мир, 2002.
12. Гуров А.А., Бадаев Ф.З., Овчаренко Л.П., Шаповал В.Н. Химия. М.: Изд-во МГТУ им. Н.Э. Баумана. 2004.
ОГЛАВЛЕНИЕ
| Введение | ||
| 1. Энергетика процессов | ||
| 1.1. Внутренняя энергия, энтальпия | ||
| 1.2. Термохимия, закон Гесса | ||
| 1.3. Энтропия | ||
| 1.4. Энергия Гиббса | ||
| 1.5. Критерий самопроизвольного протекания процессов | ||
| 1.6. Изменение энергии Гиббса в окислительно-вос-становительных реакциях | ||
| Задачи и упражнения | ||
| 2. Химическое равновесие | ||
| 2.1. Истинное и кажущееся равновесие, смещение равновесия | ||
| 2.2. Количественные характеристики равновесия | ||
| Задачи и упражнения | ||
| 3. Некоторые равновесия в растворах | ||
| 3.1. Образование растворов, растворимость | ||
| 3.2. Равновесие диссоциации электролитов | ||
| 3.3. Шкала термодинамических функций образования ионов в водных растворах | ||
| 3.4. Равновесие растворения и диссоциации малорастворимого электролита | ||
| 3.5. Равновесие диссоциации воды, буферные растворы | ||
| 3.6. Гидролиз солей | ||
| Задачи и упражнения | ||
| 4. Комплексные соединения | ||
| 4.1. Общие сведения о комплексных соединениях | ||
| 4.2. Образование и разрушение комплексных соединений. Диссоциация комплексных соединений | ||
| Задачи и упражнения | ||
| 5. Окислительно-восстановительные реакции | ||
| 6. Эквивалент, закон эквивалентов | ||
| Задачи и упражнения | ||
| Приложение | ||
| Заключение | ||
| Рекомендуемая литература | ||
| Оглавление |
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 729; Нарушение авторских прав?; Мы поможем в написании вашей работы!