
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Эквивалент, закон эквивалентов
|
|
|
|
Эквивалентом называют реальную или условную частицу, соответствующую одному электрону в данной ОВР, или одному протону (одному гидроксилу, одному единичному заряду) в данной обменной реакции. Иными словами, эквивалент – это часть молекулы, приходящаяся на один электрон в данной ОВР или на один протон (один гидроксил, единичный заряд) в данной обменной реакции.
Если эквивалентом является сама молекула, то тогда он представляет собой реальную частицу; если же эквивалент составляет часть молекулы (молекулу делить на части без разрушения нельзя!), то в этом случае он будет условной частицей. Обратим внимание, что понятие "эквивалент" без указания процесса (химической реакции) не имеет смысла.
Фактор эквивалентности показывает, какую часть составляет эквивалент от молекулы. Эта величина меняется от нуля до единицы. Например, если азотная кислота восстанавливается в различных процессах до N+4O2, N+2O, N–3H4+, то ее фактор эквивалентности будет равен в первом случае единице, во втором – одной трети, в третьем – одной восьмой. Если ортофосфорная кислота в реакции с едким натром нейтрализуется до NaH2PO4, то фактор эквивалентности равен единице; если нейтрализация прошла до Na2HPO4, то фактор эквивалентности H3PO4 составит одну вторую; наконец, в случае полной нейтрализации кислоты до Na3PO4 ее фактор эквивалентности составит одну треть. Таким образом, фактор эквивалентности, как и сам эквивалент, зависит от процесса, в котором участвует данная молекула. При этом полезно помнить, что одноосновные кислоты и однокислотные основания в обменных реакциях имеют всегда фактор эквивалентности, равный единице.
Из определения понятия "эквивалент" следует, что в ОВР n эквивалентов окислителя обязано реагировать с n эквивалентами восстановителя, при этом получится n эквивалентов вещества, до которого восстановился окислитель, и n эквивалентов вещества, до которого окислился восстановитель. Аналогично в обменной реакции типа нейтрализации m эквивалентов кислоты будут реагировать с m эквивалентами основания, в результате реакции получится m эквивалентов соли и m эквивалентов воды. Названные соотношения в сущности и выражают закон эквивалентов – число эквивалентов участников процесса есть постоянная величина.
Однако эквивалент – слишком маленькая частица, и в реальных расчетах их число огромно. Поэтому аналогично тому, как от подсчета числа молекул переходят к подсчету числа молей (количества вещества), вводят понятия "моль эквивалентов" (моль экв.) и "молярная масса эквивалента " Мэкв.
1 моль экв. содержит 6,02×1023 эквивалентов, а его масса в граммах и будет молярной массой эквивалента. Очевидно, молярная масса эквивалента связана с молярной массой (М) соотношением:
Мэкв = fэкв × М. (6.1)
Число молей эквивалентов каждого из участников процесса, очевидно, может быть найдено следующим образом:

где mA и mB - массы веществ А и В.
Закон эквивалентов приобретает теперь следующую формулировку – число молей эквивалентов участников данного процесса есть постоянная величина:
nэквA = nэквB = nэквC =... = const (6.3)
Соотношения (6.1–6.3) являются достаточными для выполнения всех расчетов, связанных с понятием "эквивалент". Остановимся теперь на некоторых частных закономерностях и соотношениях.
Молярная масса эквивалента бинарного соединения, то есть соединения, состоящего из атомов двух элементов, равна сумме молярных масс эквивалентов этих элементов. Из этой закономерности, в частности, вытекают следующие соотношения. Молярная масса эквивалента любого оксида (в оксиде кислород имеет степень окисления –2) в соответствии с процессом
Э +  ® Эх
® Эх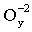
fэквO2 = 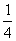 ; MэквO2 = 32 ×
; MэквO2 = 32 × 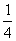 = 8 г/(моль экв.)
= 8 г/(моль экв.)
равна молярной массе эквивалента элемента плюс восемь. Аналогично молярная масса эквивалента любого водородного соединения в соответствии с процессом
Э + 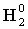 ® Э
® Э
fэквH2 =  ; MэквH2 = 2 ×
; MэквH2 = 2 ×  = 1 г/(моль экв.)
= 1 г/(моль экв.)
равна молярной массе эквивалента элемента плюс один. Молярная масса эквивалента галогенида металла (или соединения галогена с неметаллом) согласно схеме
Э + 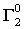 ® Э
® Э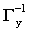
fэквГ2 =  ; MэквГ2 =
; MэквГ2 =  ×
×  = АГ
= АГ
равна молярной массе эквивалента элемента плюс атомная масса галогена. Подобные соотношения можно легко получить и для других групп соединений. Если участники процесса находятся в растворе, то число молей эквивалентов каждого из них может быть найдено умножением нормальной концентрации вещества на объем его раствора, поскольку размерность произведения нормальности на объем (в литрах!) как раз и есть число молей эквивалентов. В результате для этого частного случая закон эквивалентов принимает форму:
HA×VA = HB×VB = HC×VC =... const. (6.4)
При использовании соотношения (6.4) для нахождения объемов растворов можно использовать любые единицы измерения; в случае применения названного соотношения для нахождения числа молей эквивалентов единицей измерения объемов могут быть только литры.
Для химических расчетов с участием газов наряду с молярными массами активно используется величина 22,4 л, представляющая собой объем, который занимает 1 моль газа (строго говоря, идеального!) при нормальных условиях. Аналогично вводится величина объема 1 моль эквивалентов данного газа при н.у., которая равна:
Vэкв = fэкв × 22,4. (6.5)
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 2562; Нарушение авторских прав?; Мы поможем в написании вашей работы!