
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общая характеристика электролитов
|
|
|
|
Рис. 29. Схема электролитической диссоциации в растворе полярной молекулы HCl
Процесс электролитической диссоциации протекает одновременно с процессом растворения веществ, и поэтому в растворах все ионы находятся в гидратированном состоянии (окружены оболочками из молекул Н2О).
Однако для простоты в уравнениях химических реакций ионы изображаются без окружающих их гидратных оболочек: H+, NO3–, K+ и т.д.
2. Ионы электролитов в растворе или расплаве за счёт теплового движения хаотически перемещаются по всем направлениям. Но если в раствор или расплав опустить электроды и пропустить электрический ток, то положительно заряженные ионы электролита начинают двигаться к отрицательно заряженному электроду – катоду (поэтому они иначе называются катионами ), а отрицательно заряженные ионы – к положительно заряженному электроду – аноду (поэтому они иначе называются анионами ).
Таким образом, электролиты являются проводниками второго рода. Они переносят электрический заряд за счёт направленного движения ионов. Металлы же являются проводниками первого рода, т.к. проводят электрический ток за счёт направленного движения электронов.
3. Процесс электролитической диссоциации обратим. Наряду с распадом электролитов на ионы, может протекать обратный процесс – соединение ионов в молекулы или ассоциации. Поэтому в уравнениях реакций электролитической диссоциации веществ вместо знака равенства «=» ставят знак обратимости «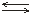 », например:
», например:
HF 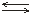 H+ + F–
H+ + F–
CH3COOH 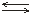 CH3COO– + H+
CH3COO– + H+
Одни электролиты в растворах полностью распадаются на ионы. Они называются сильными.
Другие электролиты только частично распадаются на ионы, т.е. большая часть их молекул остаётся в растворе в недиссоциированном виде. Такие электролиты называются слабыми.
Данное свойство вещества не абсолютно, и зависит не только от его природы, но и от природы растворителя. Чем больше диэлектрическая постоянная растворителя, тем сильнее его ионизирующая слабость. Так, в водных растворах (ε(Н2О) = 80) LiCl и NaCl ведут себя как сильные электролиты. Но если их растворить в уксусной кислоте (ε = 6) или ацетоне (ε = 21), то они начинают проявлять свойства слабых электролитов.
В водных растворах сильными электролитами являются соли, растворимые основания (образованные, как правило, щелочными и щелочноземельными металлами), некоторые неорганические или минеральные кислоты (HCl, HBr, HI, H2SO4, HNO3 и др.).
В то же время многие органические кислоты, некоторые неорганические кислоты (HNO2, HF, H2S, H2SiO3, H3PO4 и т.д.), нерастворимые в Н2О основания ведут себя как слабые электролиты.
Вещества, в которых частицы связаны различными видами химической связи, распадаются на ионы сперва по ионным связям
KНSO4 ® K+ + НSO4–,
а затем – по наиболее полярным ковалентным связям
НSO4– ® Н+ + SO42–.
Гетеролитический разрыв малополярных или неполярных ковалентных связей в процессах диссоциации таких веществ, как правило, не происходит.
Количественно процесс распада электролита на ионы оценивается с помощью степени электролитической диссоциации α.
Степень диссоциации – это физическая величина, равная отношению числа распавшихся на ионы молекул вещества или его формульных единиц (ФЕ) к общему числу его молекул (ФЕ) в растворе (распавшихся и нераспавшихся):
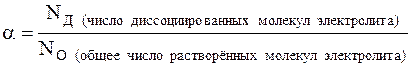
NО = NД + NH (число непродиссоциированных молекул электролита в растворе)
Так как число частиц вещества (N(Х)) и их химическое количество (n(Х)) связаны между собой соотношением
N(Х) = n(Х) ∙ NA, то степень диссоциации можно ещё рассчитать и другим способом:
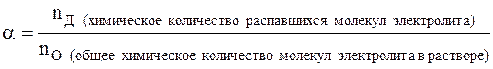
Для сильных электролитов α близка к единице. Практически все их молекулы в растворе находятся в диссоциированном виде, процесс ассоциации протекает крайне незначительно.
В связи с этим в уравнениях диссоциации данных веществ вместо знака обратимости «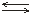 » ставят знак «®» (т.е. используют стрелку только в направлении распада), например:
» ставят знак «®» (т.е. используют стрелку только в направлении распада), например:
HCl ® H+ + Cl–
KOН ® K+ + OH–
K2SO4 ® 2K+ + SO42–
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 531; Нарушение авторских прав?; Мы поможем в написании вашей работы!