
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Под активностью ионов подразумевают ту их эффективную (условную) концентрацию, соответственно которой они количественно проявляют себя в растворе
|
|
|
|
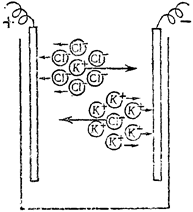
Рис. 33. Движение ионов и их ионных атмосфер в растворе сильного электролита под действием внешнего электрического поля
Рис. 32. Модель ионной атмосферы, принятая теорией Дебая и Гюккеля
 Петер Йозеф Вильгельм Дебай (1884 – 1966) – физик, лауреат Нобелевской премии по химии за 1936 год.
Петер Йозеф Вильгельм Дебай (1884 – 1966) – физик, лауреат Нобелевской премии по химии за 1936 год.
По национальности голландец. Окончил Высшую техническую школу в Ахене (1905) и Мюнхенский университет (1910). Профессор в Цюрихе (1911 и 1920), Утрехте (1912), Гёттингене (1914), Лейпциге (1927), Берлине (1935). Директор Института физики имени кайзера Вильгельма в Берлине (1935). С 1940 профессор Корнельского университета в Итаке. С 1924 года Иностранный член АН СССР.
Основные направления научной деятельности: теория теплоёмкостей твёрдого тела при низких температурах (модель Дебая); Теория теплопровод-ности диэлектрических кристаллов, понятие температуры Дебая; понятие дебаевской длины, введённое в ходе изучения явлений электролиза; дипольная теория диэлектриков. Метод Дебая-Шеррера для наблюдения интерференции рентгеновских лучей в кристаллических порошках и жидкостях. Также Дебаю принадлежит ряд работ по теории твёрдого тела, теории проводимости электролитов и др.
В частности, во внешнем электрическом поле подвижность ионов в растворах сильных электролитов уменьшается за счет «тормозящего действия» их ионных атмосфер, которые перемещаются в противоположном от ионов направлении. При этом электропроводность раствора, а значит и сила тока в нем понизятся (рис. 33). Это создаст эффект уменьшения реального числа кинетически активных частиц растворенного вещества. В результате все свойства растворов электролитов, зависящие от концентрации в них ионов, проявляются так, как если бы число ионов в растворе было меньше, чем это соответствует полной диссоциации электролита. Таким образом, экспериментально измеряется не истинная, а кажущаяся степень диссоциации сильного электролита.
Для оценки состояния ионов в растворе используют не их аналитическую концентрацию, а величину, называемую активностью (а).
Активность иона а равна его молярной концентрации с, умноженной на коэффициент активности γ
а = с · γ
Коэффициенты активности различных ионов отличаются друг от друга. Кроме этого, они зависят от концентрации раствора. В концентрированных растворах коэффициент активности обычно меньше единицы, что указывает на взаимодействие между ионами, приводящее к их взаимному связыванию. В разбавленных растворах γ приближается к единице. Это свидетельствует о слабом межионном взаимодействии, т.к. в таких растворах расстояния между ионами настолько велики, что действие меж-ионных сил почти не проявляется.
В разбавленных растворах природа ионов мало влияет на значения их коэффициентов активности. Установлено, что в таких системах величина γ зависит лишь от величины относительного заряда иона и от ионной силы раствора I (табл. 11).
Таблица 11. Коэффициенты активности одно-, двух- и трехзарядных ионов в растворах с различной ионной силой
| Ионная сила раствора, I | Коэффициент активности | ||
| однозарядные ионы | двухзарядные ионы | трехзарядные ионы | |
| 0,001 | 0,96 | 0,87 | 0,72 |
| 0,002 | 0,95 | 0,81 | 0,63 |
| 0,005 | 0,92 | 0,72 | 0,48 |
| 0,01 | 0,89 | 0,63 | 0,35 |
| 0,05 | 0,81 | 0,43 | 0,15 |
| 0,1 | 0,76 | 0,34 | 0,084 |
| 0,2 | 0,70 | 0,24 | 0,041 |
| 0,5 | 0,62 | 0,15 | 0,014 |
Под ионной силой раствора понимают полусумму произведений молярных концентраций всех находящихся в растворе ионов на квадрат их относительного заряда
I = ½ (c1z12 + c2z22 + … + cnzn2),
где с1, с2, …, сn – молярные концентрации ионов в растворе; z1, z2, …, zn – заряды ионов, находящихся в растворе.
В разбавленных растворах, ионная силы которых меньше или равна 0,01 (I ≤ 0,01), коэффициент активности рассчитывается по формуле lg γ = –0,5 z2 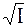 .
.
В растворах со средним разбавлением (0,5 > I > 0,01)
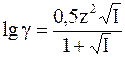
В еще более концентрированных растворах коэффициент активности рассчитывают по более сложным формулам.
Эрих Арманд Артур Йозеф Гюккель (1896 – 1980) – один из основоположников квантовой химии, создатель теории сильных электролитов (совместно с П. Дебаем).
 В 1922 Гюккель совместно с Максом Борном выполнил исследование вращательно-колебательных спектров многоатомных молекул. В 1923-1925 совместно с Петером Дебаем разработал теорию растворов сильных электролитов (теория Дебая-Гюккеля). Свойства разбавленных растворов сильных электролитов в растворителях с высокой диэлектрической проницаемостью были количественно истолкованы ими на основе предположения о полной диссоциации электролитов при учёте электростатического взаимодействия между заряженными частицами.
В 1922 Гюккель совместно с Максом Борном выполнил исследование вращательно-колебательных спектров многоатомных молекул. В 1923-1925 совместно с Петером Дебаем разработал теорию растворов сильных электролитов (теория Дебая-Гюккеля). Свойства разбавленных растворов сильных электролитов в растворителях с высокой диэлектрической проницаемостью были количественно истолкованы ими на основе предположения о полной диссоциации электролитов при учёте электростатического взаимодействия между заряженными частицами.
Ионная сила плазмы крови человека и большинства других биологических жидкостей близка к 0,15. Ионная сила изотонического раствора NaCl (0,9%) также равна 0,15. Таким образом, при проведении биохимических исследований, выполнении опытов на изолированных органах и тканях необходимо использовать не только изотонические растворы, но и растворы с одинаковой ионной силой.
При значительном увеличении ионной силы раствора в нем уменьшается количество свободной воды, не участвующей в гидратации ионов. Это приводит к дегидратации природных полиэлектролитов (белков, нуклеиновых кислот и др.), в результате чего изменяется их конформация и наблюдается частичное высаливание, т.е. выпадение данных полимеров из растворов в осадок.
Теория сильных электролитов, созданная Дебаем и Гюккелем, имеет достаточно сложный математический аппарат и безоговорочно применима к растворам, концентрация ионов в которых не превышает 0,1 моль/дм3. В этом случае выводы теории хорошо согласуются с экспериментальными данными.
Для растворов с более высокой концентрацией она уже не характеризует достаточно полно чрезвычайно сложную картину взаимодействия между всеми частицами, находящимися в системе.
В настоящее время установлено, что в более концентрированных растворах между заряженными ионами возможно образование ионных пар или ионных двойников, которые образуются за счет действия кулоновских сил и проявляют свойства электронейтральных частиц.
Например, образование ионных двойников из исходных индивидуальных ионов в растворе KCl можно схематически представить следующим образом:
K+ + Cl– = K+Cl–
Такая ассоциация ионов обнаружена в водных растворах калий-хлорида при концентрации соли ≈ 27-30 моль/дм3.
В неводных растворителях с низкой диэлектрической проницаемостью данные процессы возможны и при более низких концентрациях растворенных веществ.
Экспериментально установлено, что в концентрированных растворах электролитов наряду с незаряженными ионными парами могут образовываться и частицы более высокого порядка: ионные тройники, нейтральные ассоциаты, состоящие из двух и более ионных пар и т.д.
Вывод теоретических уравнений для расчета коэффициентов активности в таких системах возможен при установлении более точных представлений о строении электролитов, о природе и учете всех сил, которые действуют в растворе между находящимися в нем частицами растворителя и растворенного вещества.
Теория кислот и оснований.
Буферные растворы
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 335; Нарушение авторских прав?; Мы поможем в написании вашей работы!