
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Из двух и более компонентов
|
|
|
|
Равновесие в гетерогенных системах, состоящих
2.8.1 Равновесие жидкость – пар. Закон Рауля
Пусть в состоянии равновесия находятся жидкость и выделяющийся из нее пар. В соответствии с теоремой равновесия Гиббса химический потенциал любого компонента в системе одинаков во всех фазах:
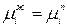 .
.
Выразим химический потенциал i -го компонента в жидкой фазе через его термодинамическую активность, а в паровой фазе – через его парциальное давление, то есть примем, что паровая фаза идеальна. Тогда получим:
 .
.
Преобразуем уравнение:
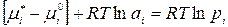 .
.
Значение выражения, заключенного в скобки, найдем из граничного условия: если xi = 1, то γi = 1, 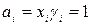 и
и 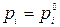 ,следовательно,
,следовательно,
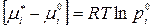 ,
,
где 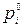 – давление насыщенного пара над индивидуальным i- м компонентом при температуре раствора.
– давление насыщенного пара над индивидуальным i- м компонентом при температуре раствора.
Подставим в уравнение вместо выражения в скобках его значение:
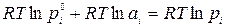 ,
,
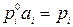 .
.
Выразив активность через мольную долю и коэффициент активности, получим:
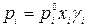 , (2.8)
, (2.8)
Уравнение (2.8) выражает основной закон жидких растворов – закон Рауля.
Применительно к идеальным жидким растворам (γi → 1) уравнение (2.8) запишется
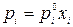 .
.
Рассмотрим идеальный жидкий раствор, состоящий из летучих компонентов А и В, тогда:
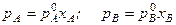
Выразим мольную долю компонента А через мольную долю компонента В:
хА = 1 – хВ.
Общее давление над раствором складывается из парциальных давлений компонентов р = рА + рВ, тогда
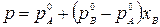
Таким образом, зависимость давления насыщенного пара компонентов и общего давления пара от состава раствора является линейной.
Зависимость давления насыщенного пара от состава двухкомпонентного раствора представляется в виде диаграммы р(рА, рВ) – х (рис. 2.2).
 Для описания зависимости давления насыщенного пара компонента от состава реального раствора используют закон Рауля в виде:
Для описания зависимости давления насыщенного пара компонента от состава реального раствора используют закон Рауля в виде:
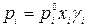
Для реального раствора, содержащего летучие компоненты А и В общее давление над раствором равно:
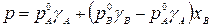 .
.
|
Отклонения давления пара от линейной зависимости в сторону больших значений называют положительными, а в сторону меньших значений – отрицательными. Величина и вид отклонений зависят от сил взаимодействия между частицами. Силы взаимодействия межу частицами идеального раствора такие же, как и в чистых жидкостях, поэтому отклонений не возникает. В реальных растворах при уменьшении сил межмолекулярного взаимодействия усиливается испарение. Следовательно, увеличивается давление насыщенного пара и возникает положительное отклонение от линейной зависимости. Закономерности для растворов с отрицательными отклонениями имеют противоположный характер (рис. 2.3).
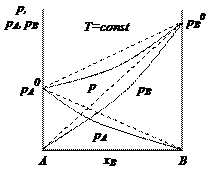 | |||
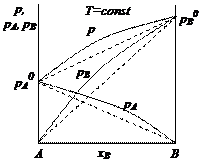 | |||
а б
Рис. 2.3. Диаграмма состояния реальных растворов: а – с отрицательными отклонениями; б – с положительными отклонениями
Состав равновесного с жидким раствором пара (уi) определяется согласно закону Дальтона:
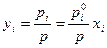 – для идеального раствора;
– для идеального раствора;
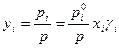 – для реального раствора.
– для реального раствора.
Для представления данных по фазовому равновесию жидкость-пар кроме рассмотренных диаграмм применяются также диаграммы давление пара – состав (р – х(у)), температура кипения – состав (Т – х(у)) и состав пара – состав раствора (y – x) (рис. 2.4).
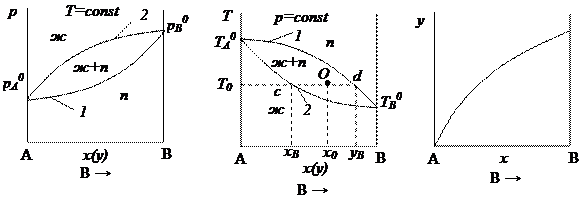 |
Рис. 2.4. Диаграммы давление пара – состав (р – х(у)), температура кипения –
состав (Т – х(у)) и состав пара – состав раствора (y – x)
На представленных диаграммах:
точке А соответствует чистому компоненту А (100 %);
точке В – чистому компоненту В (100 %);
На диаграмме р – х(у):
1 – кривая зависимости давления насыщенного пара от состава пара;
2 – кривая зависимости давления насыщенного пара от состава жидкости.
Область ниже кривой состава пара отвечает состоянию гомогенной системы – пара; область выше кривой состава жидкости отвечает состоянию жидкости.
На диаграмме Т – х(у):
1 – кривая зависимости температуры кипения от состава пара;
2 – кривая зависимости температуры кипения от состава жидкости.
Область выше кривой состава пара отвечает состоянию гомогенной системы – пара; область ниже кривой состава жидкости отвечает состоянию жидкости.
Область, лежащая между кривыми состава пара и состава жидкости отвечает состоянию гетерогенной системы жидкость-пар, любая точка внутри этой области характеризует состояние равновесия между жидкостью и паром. Например, на диаграмме Т – х(у) в точке О при температуре Т 0 находится гетерогенная система, состоящая из жидкости и пара общий состав которой равен х 0. Точки с и d выражают составы равновесных жидкости х В и пара у В.
Таким образом, составы жидкости и равновесного с нею пара в общем случае неодинаковы.
Если известна масса гетерогенной смеси в точке О m, то по правилу рычага можно рассчитать массы равновесных фаз:
 .
.
|
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 370; Нарушение авторских прав?; Мы поможем в написании вашей работы!