
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние давления (для реакций, идущих в газовой фазе)
|
|
|
|
Влияние концентрации реагирующих веществ.
Влияние внешних условий на протекание химической реакции
Для оценки возможности протекания химической реакции используется величина химического сродства, то есть мера способности веществ взаимодействовать друг с другом. Мерой химического сродства является изменение энергии Гиббса ΔG, которое можно рассчитать по уравнению изотермы химической реакции:
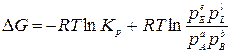 .
.
Обозначим
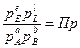
Из уравнения изотермы следует, что величина и знак ΔG зависит от соотношения Кр и Пр:
– если Кр > Пр, то Δ G < 0 и реакция протекает самопроизвольно слева на право;
– если Кр < Пр, то Δ G > 0, самопроизвольно идет обратная реакция
– если Кр = Пр, то Δ G = 0, реакция находится в состоянии равновесия.
Таким образом, если известны значение Кр и парциальные давления реагентов, с помощью уравнения изотермы можно расчетным путем предсказать направление протекания реакции, а также рассчитать выход продуктов реакции при заданных условиях.
Рассмотрим влияние некоторых факторов на положение равновесия.
Если в систему добавлено исходное вещество, то Пр < Кр, следовательно, Δ G < 0 и в системе протекает самопроизвольный процесс, направленный в сторону расходования исходных веществ и образования продуктов реакции. Если в систему добавлен продукт реакции, то Пр > Кр, Δ G > 0 и протекает обратный процесс.
Так как Кр зависит только от температуры, то изменение давления не влияет на ее величину. Однако давление влияет на объем системы, следовательно, в этом случае будет меняться Кх для реакций, протекающих с изменением объема. Константа равновесия Кх связана с Кр уравнением:
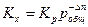 ,
,
Из которого следует, что характер влияния давления на химическое равновесие определяется знаком величины Δ n. Если реакция идет с увеличением объема, то Δ n > 0, и Кх уменьшается, следовательно равновесие смещается в сторону исходных веществ. Для реакций, протекающих с уменьшением объема, Δ n < 0 и равновесие смещается в сторону продуктов реакции.
|
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 649; Нарушение авторских прав?; Мы поможем в написании вашей работы!