
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние температуры на химическое равновесие
|
|
|
|
Для химической реакции, протекающей при р, Т = const:
аА + вВ = eЕ + lL,
стандартное изменение энергии Гиббса равно
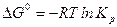 .
.
Так как
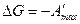
получим
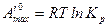 , (3.3)
, (3.3)
где 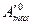 – максимальная полезная работа реакции, протекающей в стандартных условиях
– максимальная полезная работа реакции, протекающей в стандартных условиях
Максимальная работа процесса в соответствии с уравнением Гиббса-Гельмгольца равна:
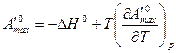 .
.
Для того чтобы найти производную 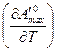 продифференцируем уравнение (3.3) по температуре:
продифференцируем уравнение (3.3) по температуре:
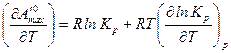 .
.
Подставим в уравнение максимальной работы Гиббса-Гельмгольца выражения для максимальной работы и ее производной по температуре:
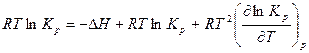 .
.
Отсюда получим
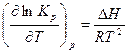 (3.4)
(3.4)
Полученное уравнение называется уравнением изобары Вант-Гоффа.
Аналогично при V, T = const получаем уравнение изохоры Вант-Гоффа:
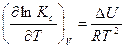 (3.5)
(3.5)
Полученные уравнения (3.4), (3.5) характеризуют влияние температуры на константу химического равновесия и позволяют спрогнозировать изменение константы химического равновесия при изменении температуры.
Проанализируем уравнения. Знак производной, стоящей в левой части уравнений, а, следовательно, и направление изменения константы равновесия при изменении Т определяется знаком теплового эффекта химической реакции. Если реакция эндотермическая (Δ Н > 0), то с увеличением температуры Кр в озрастает и равновесие смещается в сторону продуктов реакции. Если реакция экзотермическая
(Δ Н < 0), то Кр убывает, в этом случае при увеличении температуры равновесие смещается в сторону исходных веществ. Если реакция протекает без теплового эффекта, то температура на химическое равновесие не влияет.
Разделим переменные в уравнении изобары
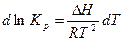
Проинтегрируем уравнение в небольшом интервале температур, считая, что ΔН не зависит от температуры:
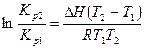 .
.
Применяя полученное уравнение, можно рассчитать средний тепловой эффект реакции, если известны значения констант равновесия в узком интервале температур или рассчитать Кp2, если известно Кр1 и средняя величина теплового эффекта реакции.
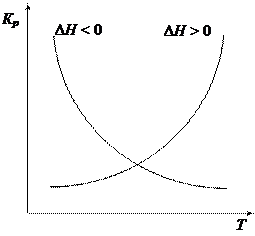 При интегрировании в широком температурном интервале необходимо учитывать зависимость ΔН от температуры:
При интегрировании в широком температурном интервале необходимо учитывать зависимость ΔН от температуры:
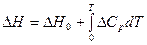 .
.
Раздел IV. Электрохимия
Электрохимия – это раздел физической химии, изучающий взаимосвязь химических процессов и электрических явлений.
Процессы, которые изучаются в данном разделе протекают в растворах или расплавах электролитов и связаны с изменением состояния ионов. Поэтому электрохимия изучает свойства растворов электролитов, ионные равновесия и электродные процессы.
Электролиты – это химические соединения, которые в растворе полностью или частично диссоциируют на ионы. Различают сильные и слабые электролиты. Сильные электролиты диссоциируют в растворе практически полностью (сильные кислоты, основания, соли). Слабые электролиты диссоциируют в растворе только частично (органические кислоты, фенолы, амины). Доля распавшихся на ионы молекул NД из числа первоначально взятых N называется степенью диссоциации:
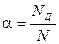 , 0 ≤ α ≤ 1.
, 0 ≤ α ≤ 1.
|
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 411; Нарушение авторских прав?; Мы поможем в написании вашей работы!