
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Между двумя несмешивающимися жидкостями
|
|
|
|
Равновесие жидкость-жидкость. Распределение вещества
 Предположим, в стакане находятся две жидкости, практически не смешивающиеся друг с другом, например, бензол и вода. Введем в эту систему третий компонент, например, небольшое количество йода. Добавленное вещество вполне определенным образом распределится между двумя жидкими фазами. При установлении равновесия в соответствии с теоремой Гиббса химические потенциалы распределяющегося вещества (йода) в соприкасающихся фазах (I) и (II) будут равны:
Предположим, в стакане находятся две жидкости, практически не смешивающиеся друг с другом, например, бензол и вода. Введем в эту систему третий компонент, например, небольшое количество йода. Добавленное вещество вполне определенным образом распределится между двумя жидкими фазами. При установлении равновесия в соответствии с теоремой Гиббса химические потенциалы распределяющегося вещества (йода) в соприкасающихся фазах (I) и (II) будут равны:
 .
.
Выразим химический потенциал третьего компонента в обеих жидких фазах через его термодинамическую активность:
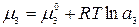 .
.
Подставим значение химического потенциала:
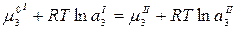 ,
,
где 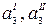 – термодинамические активности распределяющегося компонента (йода) в обеих фазах.
– термодинамические активности распределяющегося компонента (йода) в обеих фазах.
Преобразуем:
 ;
;
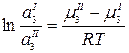 ;
;
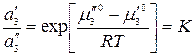 .
.
Так как стандартный химический потенциал зависит только от температуры, в правой части имеем величину, постоянную при Т = const, тогда
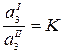
где К – коэффициент распределения вещества между несмешивающимися жидкостями.
Если количество добавленного третьего компонента мало по сравнению с массами фаз, то термодинамические активности можно заменить концентрациями:
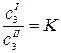 . (2.10)
. (2.10)
где 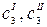 – равновесные концентрации распределяющегося вещества в соприкасающихся фазах.
– равновесные концентрации распределяющегося вещества в соприкасающихся фазах.
Уравнение (2.10) выражает известный закон распределения Нернста: отношение равновесных концентраций распределяющегося вещества в двух соприкасающихся, но не смешивающихся растворителях есть величина постоянная при Т = const.
Значения К для различных систем приведены в справочной литературе.
Если распределяющийся между фазами компонент в какой-либо из фаз подвержен диссоциации или ассоциации, то закон распределения принимает вид:
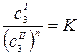 ,
,
где n = const – показатель ассоциации.
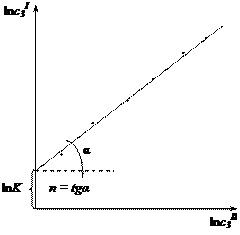 Для определения К и n уравнение приводят к линейному виду, логарифмируя правую и левую части:
Для определения К и n уравнение приводят к линейному виду, логарифмируя правую и левую части:
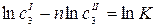 ;
;
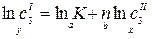 ;
;
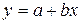 .
.
|
Закон распределения Нернста является основой для расчета процесса разделения жидких смесей методами жидкостной экстракции.
Экстракция – процесс извлечения растворенного вещества (целевого компонента) из раствора с помощью другого растворителя (экстрагента), практически не смешивающегося с первым.
Основные цели экстракции:
1. получение чистого растворителя (очистка)
2. концентрирование целевого компонента в аналитических и технологических целях.
Движущая сила экстракции – разность химических потенциалов извлекаемого вещества в растворе и экстрагенте.
При выборе экстрагента сравнивают значения коэффициента распределения, который определяют экспериментально или берут из справочника. Чем больше К, тем эффективнее экстракция при условии, что в законе распределения фазой (I) является экстрагент.
Экспериментально установлено, что лучшее извлечение компонента достигается, если экстракция осуществляется в несколько приемов небольшими порциями экстрагента, чем один раз таким же общим количеством экстрагента. Таким образом, чем больше кратность экстракции, тем эффективнее извлечение целевого компонента.
Раздел III. химическое равновесие
|
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 418; Нарушение авторских прав?; Мы поможем в написании вашей работы!