
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние температуры на скорость реакции
|
|
|
|
Температура оказывает сильное влияние на скорость химической реакции. В соответствии с эмпирическим правилом Вант-Гоффа с увеличением температуры на каждые 10 °С скорость химической реакции увеличивается приблизительно в 2 – 4 раза:
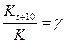 ,
,
где g - температурный коэффициент скорости химической реакции.
Ответ на вопрос, почему температура так сильно влияет на скорость реакции, дает теория активных соударений Аррениуса.
Согласно теории Аррениуса к единичному акту химического взаимодействия приводят не все соударения молекул реагирующих веществ, а только активные соударения. Активным соударением называется такое соударение, в результате которого молекулы реагирующих веществ получают избыточную (дополнительную) энергию, которую называют энергией активации. Доля активных соударений от общего числа столкновений невелика и составляет
10-20 – 10-10. Скорость реакции пропорциональна количеству активных соударений; с повышением температуры тепловое движение молекул интенсифицируется, в результате доля активных соударений молекул увеличивается, а, следовательно, увеличивается скорость реакции.
Энергия активации – это минимальное значение избыточной энергии, получаемое молекулами в момент соударения, достаточное для протекания элементарного акта химического взаимодействия. Эта энергия ослабляет существующие химические связи между атомами в молекулах и способствует перераспределению связей, то есть приводит к химическому взаимодействию. Энергия активации не зависит от температуры, а определяется только природой реагирующих веществ и характером химического взаимодействия.
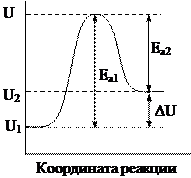 Энергия активации приближенно равна повышению энергии системы по сравнению с уровнем энергии исходных веществ. На рис. представлен график, характеризующий изменение энергии реагирующих веществ в ходе обратимой реакции: U1 – внутренняя энергия исходных веществ; U2 – внутренняя энергия продуктов реакции; ΔU – тепловой эффект реакции; Е а 1, Е а 2 – энергия активации прямой и обратной реакций.
Энергия активации приближенно равна повышению энергии системы по сравнению с уровнем энергии исходных веществ. На рис. представлен график, характеризующий изменение энергии реагирующих веществ в ходе обратимой реакции: U1 – внутренняя энергия исходных веществ; U2 – внутренняя энергия продуктов реакции; ΔU – тепловой эффект реакции; Е а 1, Е а 2 – энергия активации прямой и обратной реакций.
Как видно из рис., тепловой эффект реакции равен
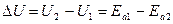 .
.
Запишем уравнение изохоры химической реакции
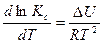 ,
,
где Кс – константа химического равновесия.
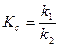 ,
,
где k1, k2 – константа скорости прямой и обратной реакций соответственно.
Подставим в уравнение изохоры выражения для Кс и ∆U:
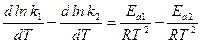 .
.
С математической точки зрения полученное уравнение справедливо лишь в том случае, если
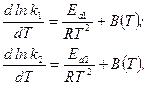
где В(Т) – некоторая постоянная, имеющая одно и то же значения для прямой и обратной реакций, зависящая от температуры.
Аррениус доказал, что для химических реакций В(Т) = 0, тогда
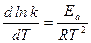 ,
,
где k – константа скорости реакции;
Еа – энергия активации.
Полученное уравнение называется уравнением Аррениуса.
Разделим переменные и проинтегрируем уравнение Аррениуса:
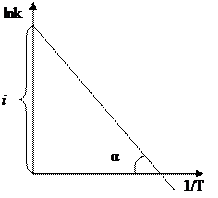
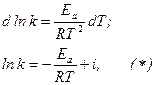
где i – константа интегрирования.
Из полученного уравнения следует, что для любой химической реакции зависимость lnk от 1/Т выражается прямой линией. Тангенс угла наклона прямой равен
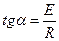 .
.
Преобразуем уравнение (*):
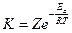 ,
,
где 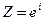 – предэкспоненциальный множитель.
– предэкспоненциальный множитель.
Энергия активации и предэкспоненциальный множитель – важнейшие характеристики химической реакции. Для расчета энергии активации и предэкспоненциального множителя достаточно знать константу скорости реакции при двух температурах.
При интегрировании уравнения Аррениуса в интервале температур от T1 до Т2 получаем уравнение, которое часто применяют в расчетах:
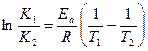 .
.
|
|
|
|
|
Дата добавления: 2013-12-11; Просмотров: 692; Нарушение авторских прав?; Мы поможем в написании вашей работы!