
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гибридизация атомных орбиталей
|
|
|
|
Для объяснения строения некоторых молекул в методе ВС применяется модель гибридизации атомных орбиталей (АО). У некоторых элементов (бериллий, бор, углерод) в образовании ковалентных связей принимают участие как s-, так и p-электроны. Эти электроны расположены на АО, различающихся по форме и энергии. Несмотря на это связи, образованные с их участием, оказываются равноценными и расположены симметрично. В молекулах ВеС12, ВС13 и СС14, например, валентный угол С1-Э-С1 равен 180, 120, и 109.28о. Значения и энергии длин связей Э-С1 имеют для каждой из этих молекул одинаковое значение.
Принцип гибридизации орбиталей состоит в том, что исходные АО разной формы и энергии при смешении дают новые орбитали одинаковой формы и энергии. Тип гибридизации центрального атома определяет геометрическую форму молекулы или иона, образованного им.
Рассмотрим с позиций гибридизации атомных орбиталей строение ряда молекул.
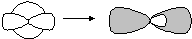 ЛИНЕЙНАЯ
МОЛЕКУЛА
ЛИНЕЙНАЯ
МОЛЕКУЛА
 рис. 6
рис. 6
| В молекуле ВеС12 центральным атомом является бериллий, у которого валентные электроны – 2s12p1. Образующиеся две sp-гибридидные орбитали расположены на одной линии под углом 180о. Таким образом, молекула хлорида бериллия имеет линейную конфигурацию (рис.6). Такой же гибридизацией объясняется угол между связями в соединениях Mg, Zn,Cd, Hg, C в СО2 и С2Н2. |
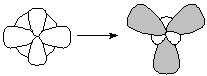
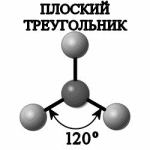 рис. 7
рис. 7
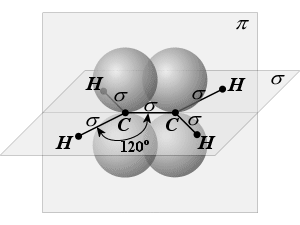
| При гибридизации одной s- и двух p-орбиталей образуются три равноценных sp2-гибридидных орбитали, расположенных в пространстве под углом 120о. Такой тип гибридизации наблюдается в молекуле ВС13. У атома бора валентными являются 2s12p2-электроны. Благодаря чему эта молекула имеет форму плоского треугольника (рис.7). Подобные гибридные орбитали осуществляют химические связи со стороны атомов В, In, Tl в молекулах, например, тригалогенидов или углерод в карбонат-анионе СО32- и в С2Н4. |
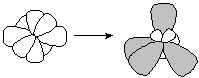
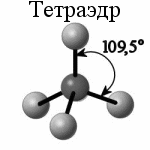 рис. 8
рис. 8
| Если в химической связи участвуют одна s- и триp-орбитали, то в результате их гибридизации образуются четыре sp3-орбитали, расположенных в пространстве под углом 109о. Такой тип гибридизации характерен для атомов углерода (валентные электроны - 2s12p3) в предельных углеводородах, азота в катионе аммония, титана, кремния и др. атомов в некоторых соединениях. Образованные таким образом соединения с одним центральным атомом имеют форму тетраэдра (рис.8). |
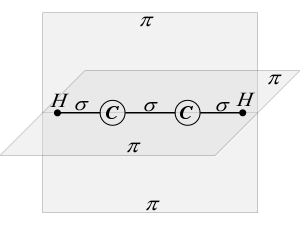
Рассмотрим с позиций гибридизации молекулу ацетилена С2Н2. В молекуле ацетилена каждый атом углерода находится в sp-гибридном состоянии, образуя две гибридные связи, направленные под углом 180° друг к другу. Как в случае связей С-С, так и в случае связей С-Н возникает общее двухэлектронное облако, образующее σ-связи.
Но в молекуле ацетилена в каждом из атомов углерода содержится еще по два р-электрона, которые не принимают участия в образовании σ-связей. Молекула ацетилена имеет плоский линейный «скелет», поэтому оба р-электронных облака в каждом из атомов углерода выступают из плоскости молекулы в перпендикулярном к ней направлении. При этом происходит также некоторое взаимодействие электронных облаков, но менее сильное, чем при образовании σ-связей. В итоге в молекуле ацетилена образуются еще две ковалентные углерод-углеродные связи, называемые p-связями (рис.9).
|
МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ (МО)
В основе метода молекулярных орбиталей лежит положение о том, что при образовании химической связи атомные орбитали атомов утрачивают свою индивидуальность. В результате комбинации этих атомных орбиталей возникают молекулярные орбитали сложной формы, принадлежащие всей молекуле в целом, т. е. являющиеся многоцентровыми.
Образование молекулярных орбиталей из атомных изображают в виде энергетических диаграмм, где по вертикали откладывают значения энергии. Комбинация АО приводит к двум типам МО. Связывающие МО характеризуются повышенной концентрацией электронной плотности между ядрами атомов и более низким уровнем энергии (в сравнении с исходными АО). Нахождение электронов на таких орбиталях энергетически выгодно и приводит к образованию связи. Разрыхляющие МО характеризуются пониженной концентрацией электронной плотности между ядрами и более высоким уровнем энергии (в сравнении с исходными АО). Нахождение электронов на таких орбиталях энергетически невыгодно и не приводит к образованию связи. Разрыхляющие МО иначе называют антисвязывающими.
Заполнение МО осуществляется в порядке возрастания энергии и согласуется с принципом Паули и правилом Гунда.
С позиций метода МО возможно объяснение образования химической связи для частиц с одним электроном, например, Н2+. Возможность и невозможность образования простейших двухатомных молекул по методу МО можно рассмотреть на примере Н2 и Не2 (рис.10).
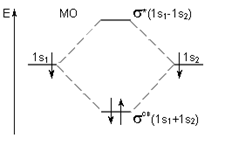
| рис. 10. Энергетическая диаграмма атомных и молекулярных уровней водорода в молекуле Н2 |
|
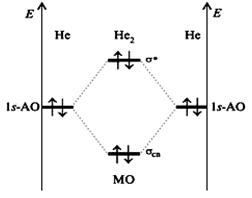 Для оценки прочности связи в методе МО введен параметр, называемый порядком связи. Порядок связи рассчитывается как полуразность суммы электронов на связывающих и разрыхляющих орбиталях. Чем выше значение порядка связи, тем прочнее молекула и выше энергия связи. Так, в молекуле Н2 (см. диаграмму 3) порядок связи равен 1. В молекуле Не2 порядок связи равен нулю, это означает, что такая молекула не существует, так как при ее образовании энергия системы не изменяется (рис. 11)
Для оценки прочности связи в методе МО введен параметр, называемый порядком связи. Порядок связи рассчитывается как полуразность суммы электронов на связывающих и разрыхляющих орбиталях. Чем выше значение порядка связи, тем прочнее молекула и выше энергия связи. Так, в молекуле Н2 (см. диаграмму 3) порядок связи равен 1. В молекуле Не2 порядок связи равен нулю, это означает, что такая молекула не существует, так как при ее образовании энергия системы не изменяется (рис. 11)
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1748; Нарушение авторских прав?; Мы поможем в написании вашей работы!