
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физические свойства
|
|
|
|
Карбоксилирование металлоорганических соединений.
Б) Карбонилирование спиртов илкилиодидов.
А) Гидрокарбоксилирование непредельных углеводородов.
Алкины и алкены реагируют с оксидом углерода и водой в присутствии карбонилов металлов с образованием монокарбоновых кислот.
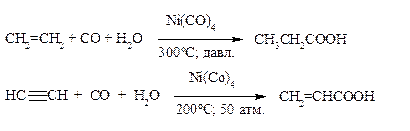
Этот способ приводит к увеличению углеродного скелета на один атом углерода и используют для промышленного получения карбоновых кислот. Так, в настоящее время освоено производство пропионовой кислоты из этилена, а также акриловой кислоты из ацетилена.
Метод производства уксусной кислоты, основанный на карбонилировании метанола, является наиболее экономически выгодным способом.
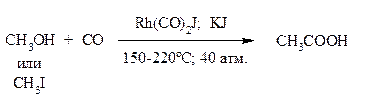
Реакция характеризуется высокой скоростью и высоким выходом (99 % по метанолу).
а) Магнийорганические соединения (реактивы Гриньяра) реагируют с диоксидом углерода и образуют соли карбоновых кислот. Карбоновую кислоту выделяют, прибавляя к реакционной смеси разбавленную минеральную кислоту.

Этот метод является одним из универсальных препаративных способов получения карбоновых кислот, поскольку магнийорганические соединения могут быть получены из первичных, вторичных и третичных алкилгалогенидов, а также из арилгалогенидов.
Литийорганические соединения можно использовать вместо магнийорганических.
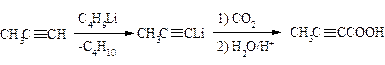
Муравьиная и уксусные кислоты обладают раздражающим запахом. Масляная, валериановая, и капроновая кислоты маслянистые малоподвижные жидкости с неприятным запахом. Высшие жирные кислоты не имеют запаха, поскольку обладают малой летучестью. Температуры кипения кислот выше, чем у соответствующих спиртов.
Особенностью молекулярной структуры карбоновых кислот является их склонность к димеризации. Например, уксусная кислота существует в виде димера и в кристалле (тпл. 16оС), и в жидкой фазе и в газообразном состоянии. Димеризация – это общее свойство карбоновых кислот.

Кроме циклических димеров существуют линейные олигомеры:

Образование димерных или олигомерных ассоциатов за счет сильных водородных связей приводит к резкому увеличению температуры кипения.
Соединение СН3СНО СН3СН2ОН СН3С(О)ОН
Т.кип. 22 78 118
Молекулы карбоновых кислот образуют водородную связь с водой, поэтому они(низшие представители) хорошо растворимы в воде:

| Соединение | СН3СООН | PhCOOH | CH3COCH3 | CH3CH2-OH | ||
| мономер | димер | мономер | димер | |||
| Длина связи, Ао, С - О С = О | 1.36 1.21 | 1.33 1.23 | - - | 1.29 1.24 | - 1.2 | 1.42 - |
Из таблицы видно, что димеризация сближает значения длин углерода с кислородом, особенно характерно для бензойной кислоты. Связь >С=О длинее, чем в кетонах, а связь С-О –короче, чем в спиртах. Это, видимо подтверждает р-π-взаимодействие в карбоксильной группе:

В случае бензойной кислоты, видимо, орбиталь карбоксильной группы смешивается с π-орбиталями бензольного ядра.
Соединение СН3СН2СООН PhOH CH3COOH
Энергия С-О 91 103 109
связи О-Н 102 85 112
Связь С-О в кислотах становится более прочной, чем даже у фенола. Причина, видимо, та же самая: р-π-сопряжение в карбонильной группе.
Для карбоксильной группы можно привести резонансные структуры:

ВЗМО уксусной кислоты, как и в других соединениях, содержащих >С=О группу является nO (C=O)-орбиталь. Орбиталь НЭП атома кислорода гидроксильной группы оказывается третьей сверху.

В общей оценке реакционной способности следует отметить, что карбоновые кислоты имеют несколько реакционных центра:
- ОН – кислотный центр, за счет которого карбоновые кислоты проявляют кислотные свойства в реакциях с основаниями;
- электрофильный центр – атом углерода карбоксильной группы, при участии которого карбоновые кислоты и их функциональные производные вступают в реакции нуклеофильного замещения;
- основный центр – оксогруппа со своей неподеленной парой электронов, которая протонируется на стадии калализа в реакциях нуклеофильного замещения;
- СН-кислотный центр, возникающий у α-атома углерода за счет индуктивного эффекта карбоксильной группы.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1505; Нарушение авторских прав?; Мы поможем в написании вашей работы!