
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поведение сильных и слабых однокислотных оснований в водных растворах
|
|
|
|
1. Сильные однокислотные основания (МОН) диссоциируют в водных растворах нацело (α = 1) и рН в растворах таких оснований определяется исходной концентрацией основания С (МОН):
МОН → М+ + ОН-
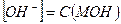 и
и 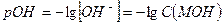
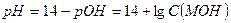
Сильными однокислотными основаниями являются гидроксиды щелочных металлов – LiOH, NaOH, KOH. Например, в 0,1 М растворе NaOH:
NaOH → Na+ + OH- и рОН = -lg C (NaOH) = -lg0,1 = 1 и рН = 14 - 1 = 13
2. Слабые однокислотные основания (ВОН) диссоциируют в водных растворах частично и при этом устанавливается динамическое химическое равновесие: ВОН ↔ В+ + ОН-, которое характеризуется соответствующей константой равновесия – константой основной диссоциации Kb:
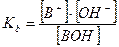
При условии, что 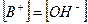 и
и 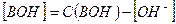 , имеем:
, имеем:
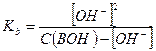
Где 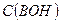 - исходная концентрация основания в растворе.
- исходная концентрация основания в растворе.
Константа основной диссоциации Kb (или ее показатель p Kb = -lg Kb) характеризует силу основания – чем меньше значение Kb (больше p Kb), тем слабее основание, и наоборот. Например, анилин (Kb = 4,3∙10-10, р Kb = 9,37) слабее, чем аммиак (Kb = 1,75∙10-5, р Kb = 4,75).
Если степень диссоциации α < 0,1, величиной 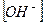 в знаменателе можно пренебречь, тогда:
в знаменателе можно пренебречь, тогда:
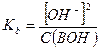
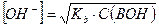
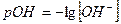 и
и 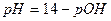
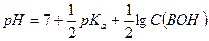
Степень диссоциации слабого основания следует рассчитывать в соответствии с определением данной величины:
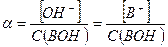
Примерами слабых однокислотных оснований являются AgOH, CuOH, NH4OH (водный раствор аммиака, NH3∙H2O), водные растворы анилина (C6H5NH2) и других органических аминов. Например, для 0,1 М раствора NH4OН:
NH4OH ↔ NH4+ + OH-
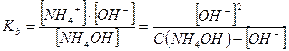
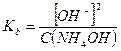
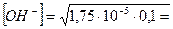
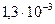 моль/л
моль/л 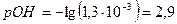
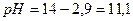
При этом 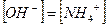 и степень диссоциации основания
и степень диссоциации основания
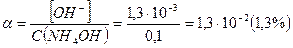
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 510; Нарушение авторских прав?; Мы поможем в написании вашей работы!