
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поведение сильных и слабых многоосновных кислот в водных растворах
|
|
|
|
Слабые многокислотные основания
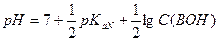
Например, рассчитать pH 0,01М раствора 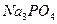 . Фосфат-ион ведет себя в растворе следующим образом:
. Фосфат-ион ведет себя в растворе следующим образом:
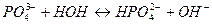
Фосфат-ион является слабым основание и pH рассчитывают по формуле
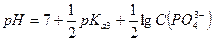
1. Сильные многоосновные кислоты (HnX) в водных растворах диссоциируют полностью по уравнению:
HnX → nH + + Xn-
следовательно: [Н+] = n C(HnX) и рН = -lgn C(HnX)
Пример сильной двухосновной кислоты – серная кислота H2SO4. Например, в 0,1 М растворе H2SO4:
H2SO4 → 2H + + SO4 2- рН = -lg2 C(H2SO4) = -lg0,2 = 0,7.
2. Слабые многоосновные кислоты (HnA) в водных растворах диссоциируют ступенчато и каждой ступени диссоциации отвечает своя ступенчатая константа кислотной диссоциации Kai. При этом величина каждой последующей константы превышает значение предыдущей. Например, для двухосновных слабых кислот Н2А процессы диссоциации выглядят следующим образом:
I ступень: Н2А ↔ Н+ + НА- 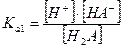 - первая константа диссоциации
- первая константа диссоциации
II ступень: НА- ↔ Н+ + А2- 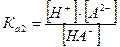 - вторая константа диссоциации
- вторая константа диссоциации
Ka1 > Ka2, так как положительно заряженному иону водорода легче оторваться от нейтральной молекулы кислоты, чем от отрицательно заряженного гидроаниона.
В таблице приведены ступенчатые константы диссоциации некоторых двухосновных кислот:
| Кислота | 
| 
|
 (щавелевая) (щавелевая)
| 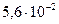
| 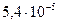
|
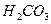 (угольная) (угольная)
| 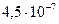
| 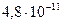
|
 (сероводородная) (сероводородная)
| 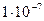
| 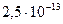
|
Формально суммарное уравнение диссоциации двухосновной слабой кислоты имеет вид:
Н2А ↔ 2Н+ + А2-
и ему соответствует общая (суммарная) константа кислотной диссоциации:
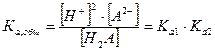
чье значение равно произведению ступенчатых констант диссоциации. Так как диссоциация многоосновной кислоты по первой ступени всегда протекает значительно сильнее, то и расчет рН в ее растворе проводится с использованием первой константы диссоциации и при условии, что 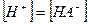 а
а 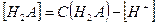 имеем
имеем
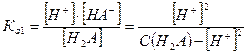
Тогда, если α < 0, то 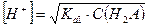 .
. 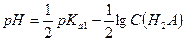 .
.
При α > 0,1 для определения 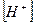 решают квадратное уравнение. Затем рассчитывают pH.
решают квадратное уравнение. Затем рассчитывают pH.
Равновесную концентрацию аниона [А2-] находят из второй константы диссоциации кислоты:
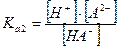
Так как 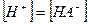 , то
, то 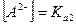 .
.
По первой ступени рассчитывается рН и в растворах других многоосновных кислот, например, трехосновных H3PO4, H3AsO4, H3SbO3 и т.д.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 676; Нарушение авторских прав?; Мы поможем в написании вашей работы!