
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сольватная (гидратная) теория растворения
|
|
|
|
Тема 7. Растворы. Дисперсные системы
Лекции 10-12 (6 ч)
Цель лекций: изучить основные положения сольватной (гидратная) теории растворения; общие свойства растворов (законы Рауля, Вант-Гоффа, осмотическое давление, уравнение Аррениуса); типы жидких растворов, дать определение растворимости; рассмотреть свойства слабых электролитов (константу растворимости, закон разбавление Оствальда, ионное произведение воды, рН среды, произведение растворимости); свойства сильных электролитов (теорию Дебая-Хюккеля, ионную силу раствора); дать классификацию дисперсных систем; рассмотреть устойчивость коллоидных растворов, коагуляцию, пептизацию, получение коллоидно-дисперсных систем и свойства коллоидно-дисперсных систем (молекулярно-кинетические, оптические и электро-кинетические).
Изучаемые вопросы:
7.1. Сольватная (гидратная) теория растворения.
7.2. Общие свойства растворов.
7.3. Типы жидких растворов. Растворимость.
7.4. Свойства слабых электролитов.
7.5. Свойства сильных электролитов.
7.6. Классификация дисперсных систем.
7.7. Получение коллоидно-дисперсных систем.
7.8. Устойчивость коллоидных растворов. Коагуляция. Пептизация.
7.9. Свойства коллоидно-дисперсных систем.
Растворами называются гомогенные системы, состоящие из двух или более веществ, состав которых может меняться в довольно широких пределах, допустимых растворимостью. Всякий раствор состоит из нескольких компонентов: растворителя (А) и растворенного вещества одного или нескольких (В).
Компонент – это однородная по химическим свойствам часть термодинамической системы, которая может быть выделена из нее и существовать в свободном виде сколь угодно долго.
Растворитель – это компонент, концентрация которого выше концентрации других компонентов в растворе. Он сохраняет свое фазовое состояние при образовании растворов.
Любой раствор характеризуется такими свойствами, как плотность, температура кипения, температура замерзания, вязкость, поверхностное натяжение, давление растворителя над раствором, осмотическое давление и т. д. Эти свойства изменяются плавно при изменении давления, температуры, состава (концентрации). Концентрация раствора указывает количество вещества, которое содержится в определенном весовом количестве раствора или растворителя или в определенном объеме раствора. В химии применяются разнообразные способы выражения концентрации растворов:
Массовая доля растворенного вещества (процентная концентрация (w)) показывает число г растворенного вещества (mв) в 100 г раствора (mр), выражается в %:
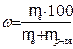 (7.1)
(7.1)
Молярная концентрация (С) показывает число моль растворенного вещества (n) в 1 дм³ раствора (V):
 (7.2)
(7.2)
Выражается в моль/дм³, например, С(1/1Н2SO4) = 0,1 моль/дм³.
Молярная концентрация эквивалента – это число молей-эквивалентов растворенного вещества в 1 дм³ раствора (V):
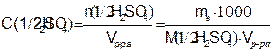 (7.3)
(7.3)
Выражается в моль/дм³. Например, С(1/2Н2SO4) = 0,1 моль/дм³; С(1/5 KМnO4) = 0,02 моль/дм³.
Понятия эквивалент, фактор эквивалентности (например, fэкв(HCl) = 1/1; fэкв(Н2SO4 ) = 1/2; fэкв(Na2CO3) = 1/2; fэкв(KMnO4) = 1/5) и молярная масса эквивалента (например, для карбоната натрия: M(1/2 Na2CO3) = fэквM(Na2CO3) = 1/2 M(Na2CO3)) были рассмотрены во введении (параграф 2).
Моляльность ( Сm) показывает число моль (n) растворенного вещества в 1000 г растворителя (mр-ля):
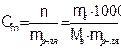 (7.4)
(7.4)
Выражается в моль/кг растворителя, например Сm(NaCl) = 0,05 моль/кг.
Мольная доля – это отношение числа молей вещества к сумме чисел молей в растворе:
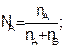
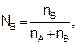 (7.5)
(7.5)
где NА и NВ – мольная доля растворителя и растворенного вещества, соответственно. Мольная доля, умноженная на 100 %, образует мольный процент, поэтому
NА+ NВ = 1. (7.6)
В практической работе важно уметь быстро переходить от одних единиц концентрации к другим, поэтому важно помнить, что
mр-ра = Vр-раρ, (7.7)
где mр-ра – масса раствора, г; Vр-ра – объем раствора, см3; ρ – плотность раствора, г/ см3.
Процесс растворения является сложным физико-химическим процессом, в котором наиболее ярко проявляется взаимодействие между частицами (молекулами или ионами) различной химической природы.
На процессы растворения многих веществ, находящихся в различных агрегатных состояниях, большое влияние оказывает полярность молекул растворителя и растворенного вещества. Необходимо отметить, что подобное растворяется в подобном. В полярных растворителях (вода, глицерин) растворяются полярные молекулы (KCl, NH4Cl и т.д.); в неполярных растворителях (толуоле, бензине, и т.д.) растворяются неполярные молекулы (углеводороды, жиры и т.д.).
Современная теория растворения основана на физической теории Вант-Гоффа и С. Аррениуса и химической теории Д. И. Менделеева. Согласно этой теории процесс растворения состоит из трех стадий:
1) механическое разрушение связей между частицами растворенного вещества, например, разрушение кристаллической решетки соли (это физическое явление);
2) образование сольватов (гидратов), т. е. нестойких соединений частиц растворенного вещества с молекулами растворителя (это химическое явление);
3) самопроизвольный процесс диффузии сольватированных (гидратированных) ионов по всему объему растворителя (это физический процесс). В растворе всякая заряженная частица (ион или полярная молекула) окружается сольватной оболочкой, которая состоит из ориентированных соответствующим образом молекул растворителя. Если растворителем является вода, то употребляется термин гидратная оболочка, а само явление носит название гидратация.
Процесс образования растворов сопровождается тепловым эффектом, который может быть как эндотермическим, так и экзотермическим. Первая стадия растворения всегда проходит с поглощением тепла, а вторая может проходить как с поглощением, так и с выделением тепла. Следовательно суммарный тепловой эффект растворения зависит от теплового эффекта образования сольватов (гидратов). Соединения молекул или ионов растворяемого вещества с молекулами растворителя осуществляется, главным образом, за счет водородной связи, или же вследствие электростатического взаимодействия полярных молекул веществ. Состав сольватов (гидратов) меняется в зависимости от температуры и концентрации растворяемого вещества. С их повышением число молекул растворителя входящего в сольват (гидрат) уменьшается. Таким образом, растворы занимают промежуточное положение между механическими смесями и химическими соединениями.
Теория растворов еще не позволяет в любом случае предсказывать свойства растворов по свойствам их компонентов. Объясняется это чрезвычайно большим разнообразием и сложностью взаимодействий между молекулами растворителя и частицами растворенного вещества. Структура растворов, как правило, бывает значительно сложнее строения его отдельно взятых компонентов.
По агрегатному состоянию все растворы делятся на три группы: растворы газов в газах или газовые смеси; жидкие растворы; твердые растворы (сплавы металлов). В дальнейшем будут рассматриваться только жидкие растворы.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1839; Нарушение авторских прав?; Мы поможем в написании вашей работы!