
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы жидких растворов. Растворимость
|
|
|
|
Откуда
p = CRT, (7.11)
где p – осмотическое давление, Па; С – молярная концентрация раствора, моль/дм3.
Осмотическое давление – это давление, которое наблюдается в растворах и вызывается ударами частиц растворенного вещества о стенки сосуда. Его измеряют с помощью приборов, называемых осмометрами. Простейший осмометр состоит из широкого сосуда с растворителем и осмотической ячейки с раствором, дно ячейки затянуто полупроницаемой мембраной. Мембраны способны пропускать частицы растворителя и задерживать частицы растворенного вещества.
В осмометре действуют две противоположно направленные силы: сила осмотического давления, которая способствует всасыванию растворителя внутрь осмометра, и гидростатическое давление столба жидкости в осмометре, которая препятствует, и в конечном счете, прекращает осмотическое всасывание растворителя. В момент равновесия осмотическое давление можно рассчитать по уравнению:
p = rh, (7.12)
где r – плотность раствора; h – высота поднятия коллоидного раствора в осмометре.
Для растворов электролитов осмотическое давление, определенное на осмометре всегда больше, чем рассчитанное по уравнению (7.11). Это связано с тем, что в электролитах молекул диссоциируют на ионы, то есть, увеличивается общее число частиц в растворе, а, следовательно, и осмотическое давление. Поэтому Вант-Гофф ввел изотонический коэффициент (i), который показывает во сколько раз осмотическое давление, определенное опытным путем больше рассчитанного:
i = pоn/pвыч. (7.13)
Вычисляют изотонический коэффициент по уравнению Аррениуса:
i = 1 + (k – 1)a, (7.14)
где k – число ионов, на которое диссоциирует электролит (например, для AlCl3 = Al+3 + 3Cl-, k = 4); a – степень диссоциации электролита, которая показывает долю продиссоциированных молекул электролита.
a = ч исло частиц, подвергнутых диссоциации
общее число частиц в растворе
Изотонический коэффициент меняется в пределах от 1 до 5 и относится только к растворенному веществу. Для разбавленных растворов электролитов уравнения (7.8; 7.9 и 7.11) имеют вид:
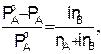 (7.15)
(7.15)
Dtз = iEкСm и Dtк = iEэСm, (7.16)
p = iCRT. (7.17)
Законы Рауля и Вант-Гоффа соблюдаются лишь в разбавленных растворах. По мере повышения концентрации растворенного вещества возрастают отклонения от законов идеальных растворов. Эти отклонения обусловлены различного вида взаимодействиями между частицами растворенного вещества, а также растворенного вещества и растворителя. Учет влияния на свойства растворов этих взаимодействий очень сложен и не всегда практически осуществим. Поэтому было предложено сохранить для описания свойств растворов все общие закономерности, применимые к идеальным растворам, но вместо входящих в них концентраций компонентов ввести активность. Активность (а) связана с концентрацией следующим соотношением:
а = gС, (7.18)
где g – коэффициент активности, который формально учитывает все виды взаимодействия частиц в данном растворе, приводящие к отклонению от свойств идеального раствора. Его вычисляют по экспериментальным данным или, используя теоретические методы расчета, с некоторыми из них познакомимся далее.
Таким образом, общие свойства растворов выражаются законами Рауля и Вант-Гоффа. В реальных растворах вместо концентраций используется активность.
Способность к образованию жидких растворов выражена в различной степени у различных индивидуальных веществ. Одни вещества способны растворяться неограниченно (вода и спирт), другие – лишь в ограниченных количествах (поваренная соль в воде).
Процесс растворения – самопроизвольный процесс, идущий с убылью свободной энергии. Жидкие растворы можно разделить на: растворы газов в жидкостях; растворы жидкостей в жидкостях; растворы твердых тел в жидкостях. Рассмотрим каждый тип жидких растворов.
Растворы газов в жидкостях. Газы при соприкосновении с жидкостями способны растворяться в ней. Растворимость газов зависит от их природы, характера жидкости, посторонних примесей, а также от давления и температуры. Растворимость одних и тех же газов в различных растворителях разная. Газы, молекулы которых неполярны, растворяются, как правило, лучше в неполярных растворителях. И, наоборот, в полярных растворителях лучше растворяются газы, молекулы которых полярны. Например, растворимость аммиака выше всего в воде, как в сильно полярной жидкости (87,6 г в 100 г H2O), толуоле же, как в неполярном растворителе, растворимость его ничтожна (0,048 г в 100 г толуола).
Посторонние электролиты, содержащиеся в воде, как правило, уменьшают растворимость газов; неэлектролиты, склонные к дегидратации, понижают растворимость газов в воде, а не склонные к дегидратации незначительно повышают растворимость газов в воде.
Зависимость растворимости газов от давления выражается законом Генри (1803): растворимость данного газа в жидкости при постоянной температуре прямо пропорциональна его давлению над жидкостью:
C = KP, (7.19)
где С – концентрация газа в жидкости; P – давление газа над раствором; K – коэффициент пропорциональности, зависящий от природы газа.
Растворимость газов в сильной степени зависит от температуры. Согласно принципу Ле-Шателье, который применим для равновесных систем, растворимость газов будет уменьшаться с нагреванием и увеличиваться при охлаждении.
Закон Генри справедлив только для разбавленных растворов и при малых давлениях, т.е. когда газы подчиняются законам идеальных газов. Газы, выступающие во взаимодействии с растворителем (HCl, NH3, SO2 и др.), закону Генри не подчиняются.
Растворы жидкостей в жидкостях. В зависимости от природы жидкости могут смешиваться друг с другом в различных соотношениях:
1) смешиваются друг с другом в любых соотношениях с образованием совершенно однородного раствора (вода и глицерин, вода и этиловый спирт). При взаимном растворении жидкостей силы притяжения между молекулами различных жидкостей одинаковы с силами притяжения между молекулами одной и той же жидкости. Для подобных растворов сохраняются общие свойства растворов и выполняются законы Рауля и Вант-Гоффа;
2) обладают ограниченной растворимостью друг в друге (вода и анилин, вода и эфир). Причем растворимость зависит от природы смешиваемых жидкостей, температуры, концентрации. В зависимости от концентрации могут образовываться три фазы: насыщенный раствор первой жидкости во второй; насыщенный раствор второй жидкости в первой и двухслойная система. Второй вариант наблюдается в том случае, когда силы сцепления между разнородными молекулами значительно меньше сил сцепления между однородными молекулами, т.е. когда положительные отклонения парциальных давлений пара раствора от закона Рауля велики и превосходят некоторую предельную величину;
3) практически не растворимы друг в друге (вода и бензол, вода и ртуть).
Если в систему, состоящую из двух взаимно нерастворимых жидкостей, ввести третье вещество, которое растворимо в обеих жидкостях, то оно распределится между ними. При этом выполняется закон распределения Нернста-Шилова (1890): при постоянной температуре соотношение равновесных концентраций между несмешивающимися жидкостями (фазами) является величиной постоянной, независимой от общего количества компонентов:
Kрас = CА/СВ, (7.20)
где Крас – коэффициент распределения (зависит от природы растворителей и растворяемого вещества, температуры); CА и СВ – молярные концентрации вещества в жидкостях (фазах) А и В.
Закон распределения находится в основе методов экстракции (извлечения), в котором извлекается один из компонентов смесей (растворов) с помощью растворителя, не смешивающегося с раствором. Применяют, например, при очистке сточных вод, в распределительной хроматографии и т. д.
Растворы твердых тел в жидкостях. Растворимость твердых веществ также определяется природой растворителя и растворенного вещества и зависит от температуры. В отличие от растворимости газов, растворимость твердых тел сравнительно мало изменяется с давлением.
Растворимостью (S) данного вещества называется количество его, выраженное в граммах, насыщающее 100 г растворителя. К хорошо растворимым относят вещества, растворяющиеся более 1 г в 100 г воды; к малорастворимым относят соединения, растворяющиеся от 0,001 до 1 г в 100 г воды; к нерастворимым относят соединения, растворяющиеся менее 0,001 г в 100 г воды.
При растворении могут образоваться растворы:
1) ненасыщенные – это растворы, которые содержат растворяемое вещество в меньшем количестве, чем допустимо растворимостью;
2) насыщенные – растворы, содержащие максимальное количество вещества, допустимое растворимостью при данной температуре;
3) пересыщенные – это растворы, содержащие растворяемое вещество в большем количестве, чем насыщенные.
Пересыщенные растворы метастабильны, т. е. неустойчивы. Их получают путем охлаждения растворов близких к насыщению и применяют для перекристаллизации веществ при их очистке от примесей или выращивании кристаллов. В первом случае охлаждение проводят достаточно быстро, а во втором – медленно.
При растворении твердых веществ могут образовываться как растворы неэлектролитов, так и растворы электролитов. К ним применимы общие свойства растворов.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 653; Нарушение авторских прав?; Мы поможем в написании вашей работы!