
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Свойства слабых электролитов
|
|
|
|
При растворении в воде или других растворителях, состоящих из полярных молекул, электролиты подвергаются диссоциации, т.е. в большей или меньшей степени распадаются на положительно и отрицательно заряженные ионы – катионы и анионы. Электролиты можно поделить на две группы: слабые и сильные.
Слабыми электролитами называют электролиты, диссоциирующие в растворах не полностью, т.е. не на сто процентов. В их растворах устанавливается равновесие между молекулами, которые подверглись диссоциации и продуктами их диссоциации – ионами. Для данной системы можно применить закон действующих масс. Для процесса диссоциации кислоты
НА D Н+ + А-
Константа равновесия КС в общем виде равна
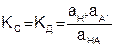 , (7.21)
, (7.21)
где аН+, аА-, аНА – активность ионов и кислоты (а = αС).
Константа равновесия для процесса диссоциации называется константой диссоциации КД. Например, константа диссоциации уксусной кислоты СН3СООН равна
СH3COOH D CH3COO- + H+
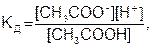 (7.22)
(7.22)
где в квадратных скобках указаны равновесные концентрации.
Для процесса диссоциации слабого основания
ROH D R+ + OH-
Константа диссоциации равна
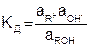 , (7.23)
, (7.23)
Например, константа диссоциации гидроксида аммония
NH4OH D NH4+ + OH-
равна
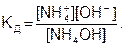 (7.24)
(7.24)
Для слабых электролитов константа диссоциации зависит от природы диссоциирующего вещества и растворителя, температуры, но не зависит от концентрации раствора. Кривая зависимости константы диссоциации многих электролитов от температуры проходит через максимум.
Константа диссоциации является характеристикой силы электролита. По величине константы диссоциации слабые электролиты делятся на умеренно слабые (КД = 10-2 – 10-4), слабые (КД = 10-5 – 10-9) и очень слабые (КД ≤ 10-10). Чем константа диссоциации соединения больше, тем сильнее данный электролит. Например, уксусная кислота (КД = 1,85.10-5) сильнее цианисто-водородной (КД = 4,8.10-10), но слабее муравьиной (КД = 1,8.10-4). Константа диссоциации имеет постоянное значение (при данной температуре) только для слабых электролитов. Подобного постоянства для сильных электролитов не наблюдается.
Для многоосновных слабых электролитов константа диссоциации расписывается для каждой ступени диссоциации. Например, для ортофосфорной кислоты (Н3РО4) константа диссоциации по первой ступени КД1 = 7,51 . 10-3, по второй ступени КД2 = 6,23 . 10-8 и по третьей КД3 = 2,2 . 10-13.
Для расчетов удобно пользоваться не константой диссоциации КД, а показателем константы диссоциации рК, который представляет собой отрицательный десятичный логарифм КД:
рК = -lgКД (7.25)
Основываясь на законе действующих масс, можно вывести уравнение, которое связывает константу диссоциации КД электролита со степенью его диссоциации (α) и с концентрацией раствора (С). В случае электролита КА, диссоциирующего на ионы К+ и А-. Концентрации ионов (активности), рассчитывают по уравнению (7.18), а концентрация вещества КА равна аКА = (1 – α)С. Подставляя эти значения в уравнение (7.21), получим:
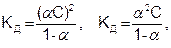 (7.26)
(7.26)
где С – молярная концентрация электролита, моль/дм³.
Выведенная формула (7.26) является аналитическим выражением закона разбавления Оствальда.
Если степень диссоциации значительно меньше единицы, то при приближенных вычислениях можно принять, что (1-α)» 1. Тогда выражение закона разбавления упрощается:
КД = α2С, откуда 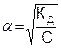 . (7.27)
. (7.27)
Последнее соотношение показывает, что при разбавлении раствора (т. е. при уменьшении концентрации электролита С) степень диссоциации электролита возрастает. Опыт показывает, что для сильных растворов закон разведения Оствальда не применим, так как для них величина КД с увеличением концентрации непрерывно возрастает.
Рассмотрим ионное произведение воды. Химически чистая вода является очень слабым электролитом, который при диссоциации образует ионы водорода (Н+) и гидроксид-ионы (ОН-):
Н2О D Н+ + ОН-.
Этому процессу соответствует константа диссоциации
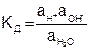 . (7.28)
. (7.28)
Поскольку степень диссоциации воды мала, то активность ионов в уравнении (7.28) могут быть заменены их концентрациями, а концентрацию не распавшихся ионов можно считать равной общей концентрации молекул воды и считать ее постоянной величиной. Поэтому уравнение (7.28) можно записать в виде:
КД[Н2О] = [H+][OH-] = КW (7.29)
где КW – ионное произведение воды. При 295 К КW = 10-14, поэтому [H+] = [OH-] = 10-7 моль/дм³. С увеличением температуры КW увеличивается. Если прологарифмировать уравнение (7.29) и умножить на -1, то получим
-рКW = рН + рОН = 14. (7.30)
где рКW – показатель ионного произведения воды; рН – водородный показатель или кислотность раствора; рОН – показатель гидроксид-ионов.
Величина рН используется для определения характера реакции раствора. Если рН = 7, то реакция нейтральная; если рН < 7, то реакция среды кислая; если рН > 7, то реакция щелочная.
Величина рН может служить критерием силы кислоты или основания. В ряду кислот более сильной будет та, у которой при одинаковой молярной концентрации активность ионов Н+ выше (рН ниже). Для оснований подобная зависимость имеет обратный характер.
Рассмотрим произведение растворимости соединений. В насыщенном растворе малорастворимого электролита устанавливается равновесие между осадком (твердой фазой) электролита и ионами электролита в растворе, например:
ВаSO4 D Ва+2 + SO4-2
в осадке в растворе
Поскольку в растворах электролитов состояние ионов определяется их активностями, то константа равновесия последнего процесса имеет вид:
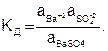 (7.31)
(7.31)
Активность твердого сульфата бария есть величина постоянная, а, следовательно, произведение КДаВаSO4 тоже является при данной температуре константой. Отсюда следует, что произведение активностей ионов Ва+2 и SO4-2 так же представляет собой постоянную величину, называемую произведением растворимости (ПР):
а(Ва+2)а(SO4-2) = ПР(ВаSO4) = 1,08.10-10 (7.32)
Произведение активностей ионов малорастворимого электролита содержащихся в его насыщенном растворе (произведение растворимости) есть величина постоянная при данной температуре – это правило произведения растворимости.
Если электролит очень мало растворим, то ионная сила его насыщенного раствора близка к нулю, а коэффициенты активности ионов мало отличаются от единицы. В подобных случаях произведение активностей ионов в уравнении (7.32) можно заменить произведением их концентраций:
ПРВаSO4 = [Ba+2][SO4-2] (7.33)
Если какой-либо трудно растворимый электролит диссоциирует с образованием нескольких одинаковых ионов (например, КnАm D nК+m + mА-n), то уравнение для ПР примет вид:
ПР(КnАm) = (а(К+m))n (а(А-n))m. (7.34)
С учетом того, что а = gС (g – коэффициент активности):
ПР(КnАm) = (nСg(К+m))n (mСg(А-n))m. (7.35)
При увеличении концентрации одного из ионов электролита в его насыщенном растворе (например, путем введения другого электролита, содержащего тот же ион) произведение концентраций ионов электролита станет больше ПР. При этом равновесие между твердой средой и раствором смещается в сторону образования осадка. Таким образом, условием образования осадка является концентрация ионов малорастворимого электролита над его произведением растворимости (аК+аА > ПР). В результате осадка концентрация другого иона, входящего в состав электролита, тоже изменяется. Устанавливается новое равновесие, при котором произведение концентраций ионов электролита вновь становится равным ПР.
Напротив, если в насыщенном растворе электролита уменьшить концентрацию одного из ионов (например, связав его каким-либо ионом), произведение концентраций ионов будет меньше значения ПР, раствор станет ненасыщенным, а его равновесие между жидкой фазой и осадком сместится в сторону растворения осадка. Следовательно, равновесие осадка малорастворимого электролита происходит при условии, что произведение концентраций ионов меньше значения ПР (аК+аА < ПР).
Например, введение в раствор малорастворимой соли сульфата бария (ПР =1,08.10-10) хорошо растворимой соли хлорида бария (ВаСl2) сдвигает равновесие в сторону образования осадка, а введение сульфата калия (К2SO4) в сторону растворения осадка.
Исходя из значений ПР, можно вычислить растворимость малорастворимых электролитов в воде и растворах, содержащих другие электролиты. Значения ПР для большинства электролитов – табличные величины (табл. 5).
Закон действующих масс применяют также при рассмотрении равновесий с участием комплексных ионов и при гидролизе солей (речь об этом пойдет в следующей теме при рассмотрении реакций обмена).
Таблица 7.5
Произведение растворимости (ПР) и растворимость
при 25°С некоторых малорастворимых веществ
| Формула | Растворимость | ПР, моль/дм3 |
| AgBr | 7,94 • 10 -7 | 6,3 • 10 -13 |
| AgCl | 1,25 • 10 -5 | 1,56 • 10 -10 |
| AgI | 1,23 • 10 -8 | 1,5 • 10 -16 |
| Ag2CrO4 | 1,0 • 10 -4 | 4,05 • 10 -12 |
| BaSO4 | 7,94 • 10 -7 | 6,3 • 10 -13 |
| CaCO3 | 6,9 • 10 -5 | 4,8 • 10 -9 |
| PbCl2 | 1,02 • 10 -2 | 1,7 • 10 -5 |
| PbSO4 | 1,5 • 10 -4 | 2,2 • 10 -8 |
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 2929; Нарушение авторских прав?; Мы поможем в написании вашей работы!