
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Особенности обменных процессов
|
|
|
|
Тема 8. Кислотно-основные и окислительно-восстановительные свойства вещества
Цель лекции: ознакомится с особенностями обменных и окислительно-восстановительных процессов, рассмотреть гидролиз солей и константу гидролиза, теории электролитической диссоциации, протонную и электронную теории кислот и оснований; дать определение степени окисления и правила расчета СО; познакомиться с методами составления уравнений окислительно-восстановительных реакций: электронного баланса и полуреакций (электронно-ионный метод); показать направление окислительно-восстановительных реакций.
Изучаемые вопросы:
8.1. Особенности обменных процессов.
8.2. Особенности окислительно-восстановительных процессов.
Химические реакции разделяются на обменные и окислительно-восстановительные (Ox-Red). Если в реакции не происходит изменение степени окисления, то такие реакции называются обменными. Они возможны при условии, что образуется осадок, малодиссоциирующее вещество или выделяется газ.
Типы обменных химических процессов в водной среде: реакции нейтрализации – процесс между кислотой и щелочью:
HCl + NaOH → NaCl + H2O,
взаимодействие между кислотой и солью:
HCl + AgNO3 → HNO3+ AgCl↓,
реакции между щелочью и солью:
Ba(OH)2 + K2SO4 → BaSO4↓ + KOH,
реакции между двумя растворимыми солями:
AgNO3 + KCl → KNO3 + AgCl↓,
гидролиз солей – реакции обмена между водой и растворенными в ней солями. Гидролизу подвергаются растворимые соли, образованные сильными кислотами и слабыми основаниями (а); слабыми кислотами и сильными основаниями (б); слабыми кислотами и слабыми основаниями (в):
а) NH4Cl + H2O D NH4OH + HCl
или в ионном виде:
NH4+ + Cl- + H2O D NH4OH + H+ + Cl-
в сокращенном ионном виде:
NH4+ + H2O D NH4OH + H+ (pH <7 – среда кислая)
константа равновесия этой системы:
KС = 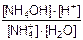
Поскольку концентрация воды при гидролизе изменяется очень мало, то ее принимают постоянной и, умножая на константу равновесия, получают константу гидролиза Kг:
KС[H2O] = Kг =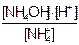 (8.1)
(8.1)
Умножим числитель и знаменатель уравнения (8.1) на концентрацию OH—ионов:
KГ = 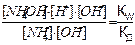 (8.2)
(8.2)
Константа гидролиза соли зависит от природы соли, температуры. Показателем глубины протекания гидролиза является степень гидролиза (β), которая представляет собой отношение концентрации гидролизованных молекул Cгидр к исходной концентрации растворенных молекул электролита:
β = Сгидр/С; (С = β.Сгидр) (8.3)
Степень гидролиза, как правило, невелика. Например, 0,1 моль/дм3 CH3COONa при 298К β = 10-4. Это связано с тем, что вода – слабый электролит и равновесие смещается в сторону исходных веществ. С увеличением температуры и снижением концентрации соли степень гидролиза снижается (гидролиз – эндотермический процесс).
Уравнение (8.1) с учетом (8.3) принимает вид:
KГ = 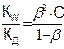 (8.4)
(8.4)
Если β << 1, то
Kг = β2C (8.5)
Следовательно
β = (8.6)
(8.6)
Используя последнее уравнение можно найти концентрацию ионов водорода, а, следовательно, и pH раствора:
[H+] = βC = 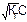 pH = -lg
pH = -lg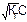 (8.7)
(8.7)
б) Гидролиз ацетата натрия:
CH3COONa + H2O D CH3COOH + NaOH
CH3COO- + H2O D CH3COOH + OH- (pH >7 – щелочная среда)
Степень гидролиза и константа гидролиза в данном случае описываются теми же уравнениями (8.2), (8.3) и (8.4), но лишь с тем исключением, что в уравнениях (8.2) и (8.4) входит константа диссоциации слабой кислоты.
Равновесную концентрацию гидроксид ионов рассчитывают по уравнению:
[OH-] = βC =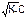 (8.8)
(8.8)
Отсюда
рH = pKв- pOH = pKв – lg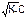 (8.9)
(8.9)
Если гидролизу подвергается многоосновный анион, то гидролиз протекает по стадиям:
CO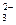 + H2O D HCO
+ H2O D HCO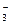 + OH-
+ OH-
HCO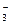 + H2O D H2CO
+ H2O D H2CO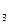 + OH-
+ OH-
константа гидролиза по первой ступени значительно выше, чем константа гидролиза по последней ступени. Например, для гидролиза CO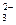 , при 298 К:
, при 298 К:
КГ1 = 2.10-4; К Г2 = 2,2.10-8.
Поэтому при расчете концентрации иона [ОН-] или [Н+], второй и третьей ступенью обычно пренебрегают. Для расчета константы гидролиза по первой ступени входит константа диссоциации слабого электролита по первой ступени:
CO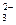 + H2O D HCO
+ H2O D HCO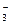 + OH-
+ OH-
равна
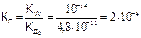
в) Рассмотрим гидролиз растворимой соли, образованной слабой кислотой и слабым основанием:
NH4F + H2O D NH4OH + HF
или в ионной форме
NH4+ + F- + H2O D NH4+ + OH- + H+ + F- (pH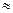 7, среда нейтральна)
7, среда нейтральна)
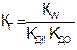 (8.9)
(8.9)
Степень гидролиза и концентрация ионов водорода в этом случае не зависит от исходной концентрации соли:
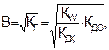 (8.10)
(8.10)
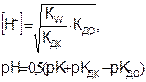 (8.11)
(8.11)
(8.12)
Как видно, в зависимости от соотношения pКД,К и pКД,О среда может иметь как кислую, так и основную реакцию.
Таким образом, при гидролизе солей, образованных слабыми кислотами или (и) основаниями, происходит подщелачивание или подкисление раствора, степень гидролиза возрастает с разбавлением раствора при увеличении температуры.
Теории кислот и оснований. При объяснении кислотно-основных взаимодействий применяют различные подходы; большинство теорий не противоречат друг другу, но имеют различные области применения. Наиболее известны теория, основанная на механизме электролитической диссоциации, протонная и электронная теории кислот и оснований.
Согласно теории электролитической диссоциации, применимой к водным растворам, кислотой является электролит, который диссоциирует с образованием ионов Н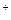 (или гидроксония Н3О+). Сильные кислоты (НСl, НNО3, Н2SО4 и др.) диссоциируют практически полностью, у слабых кислот диссоциирована лишь часть молекул. О силе кислот можно судить по константе диссоциации. Чем больше константа диссоциации, тем больше диссоциирована кислота.
(или гидроксония Н3О+). Сильные кислоты (НСl, НNО3, Н2SО4 и др.) диссоциируют практически полностью, у слабых кислот диссоциирована лишь часть молекул. О силе кислот можно судить по константе диссоциации. Чем больше константа диссоциации, тем больше диссоциирована кислота.
Электролит, диссоциирующий с образованием ОН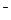 , называют основанием. Сильные основания (LiOH, NaOH, KOH и др.) диссоциируют полностью, у слабых оснований диссоциации подвергается лишь часть молекул.
, называют основанием. Сильные основания (LiOH, NaOH, KOH и др.) диссоциируют полностью, у слабых оснований диссоциации подвергается лишь часть молекул.
Амфотерные электролиты диссоциируют как кислоты (2H+ + [Zn(OH)4]-2), и как основания ([Zn(H2O)2]+2 + OH-), например:
2H+ + [Zn(OH)4]-2 D Zn(OH)2 + H2O D [Zn(H2O)2]+2 + OH-
При взаимодействии гидроксида цинка, например, с азотной кислотой образуется нитрат цинка:
Zn(OH)2 + 2НNО3 = Zn(NО3)2 + 2H2O
при взаимодействии же с гидроксидом калия – цинкат калия:
Zn(OH)2 + 2KOH = K2[Zn(OH)4]
К амфотерным электролитам так же относятся гидроксиды алюминия Al(OH)3, свинца Pb(OH)2, олова Sn(OH)2 и др. Амфотерность электролитов объясняется малым различием связей R-OH и O-H.
Теория электролитической диссоциации неприменима к взаимодействиям, не сопровождающимся диссоциацией на ионы. Например, аммиак, реагируя с безводным фтором водорода, образует соль фторид аммония NH3 + HF = NH4F. Аммиак, не имея в своем составе гидроксидной группы, ведет себя как основание.
Протонная теория кислот и оснований Д. Брендстеда (1923) применима как к водным, так и неводным средам. Согласно протонной теории, кислоту считают донором протона, а основание – акцептором протонов. При взаимодействии кислота отдает, а основание принимает протон. Соотношение между основанием и кислотой можно представить схемой:
Основание + Протон D Кислота
Основание и кислота, связанные данным соотношением, называются сопряженными. Взаимодействие между кислотой и основанием согласно протонной теории проходит по схеме:
Кислота1 + Основание2 D Кислота2 + Основание1
В зависимости от партнера, то или иное вещество может быть или кислотой, или основанием. Например, вода по отношению к аммиаку является кислотой, по отношению к фториду водорода – основанием, а при диссоциации – и как кислота, и как основание:
H2O + NH3 D OH- + NH4+
HF + H2O D F- + OH3+
H2O + H2O D OH- + OH3+
кислота основание основание кислота
Кислотно-основные свойства, согласно протонной теории, количественно характеризуются протонным сродством, или энергией, которая выделяется при присоединении протона к молекуле или иону. Роль основания играет тот партнер, у которого протонное сродство выше.
Электронная теория кислот и оснований выдвинута Дж. Льюисом (1924). Согласно этой теории, кислота является акцептором, а основание – донором электронов. Если в состав кислоты входит водород, то она называется водородной, а если не входит, то – апротонной. Взаимодействие кислоты и основания по Льюису, приводит к образованию ковалентной связи по донорно-акцепторному механизму:
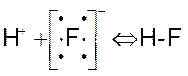
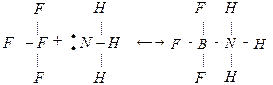
Кислота основание продукт нейтрализации
Электронная теория охватывает более широкий круг соединений, чем протонная теория.
Таким образом, кислотно-основные взаимодействия объясняются теорией электролитической диссоциации, протонной или электронной теориями.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 373; Нарушение авторских прав?; Мы поможем в написании вашей работы!