
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поляризация и перенапряжение
|
|
|
|
Классификация электродов
Все электроды можно разделить на шесть групп:
1. Электроды первого рода – это металл, погруженный в раствор своей хорошо растворимой соли, он обратим относительно катионов металла. При этом протекает обратимая электрохимическая реакция следующего вида:
Me D Men+ + ne.
Схема полуэлемента Men+/Me. Например: Zn2+/Zn и Cu2+/Cu. При расчете потенциала используют уравнение Нернста в общем виде (9.8).
2. Электроды второго рода – это металл, покрытый своей труднорастворимой солью и обратим относительно аниона. Такие электроды используют как электроды сравнения, поскольку они обладают малым температурным коэффициентом и равновесие в системе устанавливается достаточно быстро. Реакция, протекающая при этом, имеет вид MeX D Men+ + X– + ne, схема полуэлемента Me/MeX,X–. Например, хлорсеребряный электрод Ag/AgCl,Cl–; каломельный электрод Hg/Hg2Cl2,KCl; ртутно-кадмиевый электрод Hg/Hg2SO4,CdSO4. Потенциал рассчитывают по уравнению:
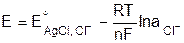 (9.9)
(9.9)
3. Газовые электроды состоят из металлического проводника, который не должен посылать в раствор собственный ионы (платина и платиновые металлы), контактирующего одновременно с газом и раствором, содержащим ионы этого раствора. Чаще всего газовые электроды используют в качестве электродов сравнения, и к ним относятся водородный и кислородный электроды.
Равновесие на водородном электроде выражается равновесием 2H+ + 2e D H2, а схема полуэлемента имеет вид H2(Pt)/2H+. Так как в реакции участвует газообразный водород, то электродный потенциал зависит от давления газа
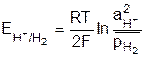 или
или 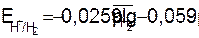 . (9.10)
. (9.10)
На кислородном электроде в щелочной среде протекает реакция O2 + 2H2O + 4e D 4OH–, а схема полуэлемента имеет вид O2(Pt)/OH–. Выражение равновесного потенциала имеет вид:
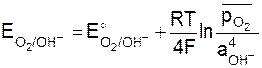 или при T = 298 K.
или при T = 298 K.
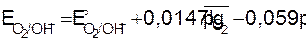 . (9.11)
. (9.11)
4. Амальгамные электроды. Амальгама – это раствор металла в ртути. Электроды подобного типа используют для металлов химически активных, те которые в чистом виде химически взаимодействуют с водой. Например, кадмиевый амальгамный электрод Cd(Hg)/CdSO4. Реакция Cd D Cd2+ + 2e. При расчетах используют уравнение Нернста в общем виде (9.8).
5. Окислительно-восстановительные электроды. Строго говоря, любая электрохимическая реакция является окислительно-восстановительной. Однако при более тонкой классификации к окислительно-восстановительным электродам относят только те электроды, в реакциях которых не принимают непосредственного участия металлы и газы. Такие электроды состоят из металлического проводника, контактирующего с раствором, содержащим окислители и восстановители. Например, Fe3++e D Fe2+(Fe3+/Fe2+) или в общем виде Ox + ne D Red, а схема Pt/Ox, Red.
Уравнение Нернста имеет вид
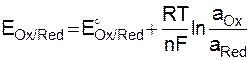 (9.12)
(9.12)
6. Мембранные электроды, например стеклянный, который представляет собой тонкостенный стеклянный шарик, заполненный раствором электролита. Содержащиеся в стекле ионы натрия (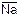 ) обмениваются в растворе с ионами водорода:
) обмениваются в растворе с ионами водорода: 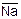 +H+ D
+H+ D 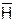 + Na+, схема полуэлемента – стекло (
+ Na+, схема полуэлемента – стекло (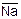 )/H+. Поскольку стеклянный электрод обратим относительно катионов водорода, то его используют в качестве индикаторного электрода и электродный потенциал рассчитывают по уравнению
)/H+. Поскольку стеклянный электрод обратим относительно катионов водорода, то его используют в качестве индикаторного электрода и электродный потенциал рассчитывают по уравнению
E = Eo – 0,0002 pH. (9.13)
Используя другой подход, классификацию электродов можно провести по-другому.
При самопроизвольных процессах устанавливается равновесный потенциал электродов. При прохождении электрического тока потенциал электродов изменяется. Изменение потенциала электрода при прохождении тока называется поляризацией:
DE = Ei – Ep, (9.14)
где DE – поляризация; Ei – потенциал электрода при прохождении тока; Ep – равновесный потенциал.
Термин «поляризация» употребляют как для обозначения величины изменения потенциала, так и самого явления изменения потенциала при прохождении тока. Различают анодную (DEа) и катодную поляризацию (DEк). Если известны причины изменения потенциала, например, катодное выделение водорода, то изменение потенциала называют перенапряжением.
Для экспериментального определения поляризации строят кривую зависимости потенциала электрода от протекающего через электрод тока. Поскольку электроды могут быть разной площади, то скорость процесса относят к единице площади поверхности, которая называется плотностью тока (i):
i = I/S [A/см2] (9.15)
Плотность тока определяет скорость электрохимических реакций и связана с потенциалом. Если процесс протекает мгновенно, то поляризация равна нулю. На практике при прохождении тока потенциал электрода изменяется, то есть возникает поляризация электрода, это связано с замедленностью какой-либо стадии электрохимического процесса: подвода реагентов, отвода продуктов реакций, химической или электрохимической стадии процесса. В зависимости от типа замедленной стадии поляризацию снижают перемешиванием раствора, применением катализаторов, увеличением температуры, концентрации реагентов и площади поверхности электродов.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 922; Нарушение авторских прав?; Мы поможем в написании вашей работы!