
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электродвижущая сила гальванического элемента
|
|
|
|
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента.
ЭДС любого гальванического элемента возникает за счет протекания в нем электрохимической реакции или за счет изменения активности ионов в растворе вблизи электрода.
При обратимом протекании химической реакции в гальваническом элементе в условиях постоянства температуры и давления получаемая электрическая энергия будет наибольшей и совершаемая системой электрическая работа будет максимальной полезной работой реакции, равной убыли изобарно-изотермического потенциала.
Wmax= –ΔG (9.2)
Если отнести эту величину к количеству электричества nF кулонов, то электрическая работа, совершаемая элементом, будет
W= nFEэ, (9.3)
где n – число электронов, участвующих в реакции; F – число Фарадея (F = 96487 ≈ 96500 Кл/моль); Eэ – ЭДС гальванического элемента, B.
Еэ = Е+ – Е–,
т. е. ЭДС гальванического элемента равна разности электродных потенциалов двух полуэлементов.
Зная, что максимальная полезная работа химической реакции также равна убыли изобарно-изотермического потенциала и применяя уравнение Вант-Гоффа, для реакции Men+ + nē ⇄ Meo можно написать
Wmax= –∆G = RT lnK – RT ln. (9.4)
В условиях обратимости реакции
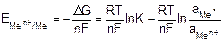 . (9.5)
. (9.5)
Обозначив через EoMen+/Me – потенциал электрода в стандартных условиях, т.е. при активностях всех ионов, участвующих в реакциях, равных единице, получим
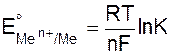 . (9.6)
. (9.6)
Уравнение (9.5) можно представить в виде
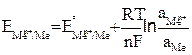 (9.7)
(9.7)
Это уравнение называется уравнением Нернста. Подставляя в уравнение (9.7) числовое значение R = 8,314 Дж/мольК и F = 96487 Кл и заменяя натуральный логарифм на десятичный с учетом того что активность твердой фазы чистых индивидуальных веществ равна единице, при Т = 298 К
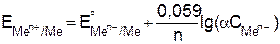 (9.8)
(9.8)
Величины стандартных потенциалов, поэтому различны у различных металлов, их определяют опытным путем, и они зависят от природы металла и температуры.
Измерить потенциал отдельного электрода невозможно, поэтому измеряют ЭДС гальванического элемента, состоящего из исследуемого электрода и электрода сравнения. В качестве электрода сравнения используют водородный электрод с активностью ионов водорода в растворе равной 1. Величину стандартного потенциала такого водородного электрода приняли равной нулю, поэтому ЭДС гальванического элемента будет равна потенциалу исследуемого металла (Еэ = Еисслед – 0 = Еисслед).
Стандартные потенциалы различных металлов, измеренные по отношению к водородному электроду, расположены в порядке возрастания, образуя ряд напряжений. Все металлы, расположенные в ряду напряжений до водорода, называются неблагородными, или химически активными. Металлы, стоящие в ряду напряжения после водорода, называются благородными, или химически неактивными. Ряд напряжений используют при вычислении электродных потенциалов и ЭДС гальванических элементов.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 834; Нарушение авторских прав?; Мы поможем в написании вашей работы!