
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Повышение давления смещает равновесие в сторону меньшего числа частиц, а понижение, в сторону большего числа частиц
|
|
|
|
Давление в системе обусловлено ударами движущихся частиц о стенки колбы (сосуда), чем больше частиц, тем выше давление и наоборот.
Влияние давления.
Уменьшение t в сторону прямой реакции.
Увеличение t смещает равновесие в сторону обратной реакции.
Влияние концентраций реагирующих веществ.
Если на физико-химическую систему находящуюся в состоянии химического равновесия, оказывать внешнее воздействие (изменять концентрации веществ, температуру, давление), то равновесие смещается в сторону реакции, противодействующей оказанному воздействию.
Качественно направление смещения химического равновесия действиек раз личных факторов позволяет оценивать принцип Ле Шателье;
Увеличение концентрации хотя бы одного из исходных веществ или отвод из сферы реакции продуктов взаимодействия смещает равновесие в сторону прямой реакции. И наоборот: уменьшение концентрации исходных веществ или увеличение с продуктов реакции проводит к смещению равновесия в сторону обратной реакции.
Для проведения прямой реакции, увеличение выхода аммиака, необходимо увеличивать концентрации исходных вещеетг или отвсттить(улавллБать) продукт реакции
2) Влияние температуры:
а) повышение температуры смещает равновесие в сторону эндотермической реакции (DН >0).
б) понижение температуры способствует протекание экзотермического процесса (DH < 0)
Для вышеприведенного примера:
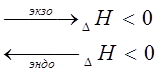
1) Увеличение Р  прямая реакция
прямая реакция
2)Уменьшение Р  обратная реакция.
обратная реакция.
Термодинамика открытых систем «Ленский» стр. 43-54
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 425; Нарушение авторских прав?; Мы поможем в написании вашей работы!