
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Получение. 1) В зависимости от числа замещенных атомов в
|
|
|
|
Физические свойства
Номенклатура
Классификация
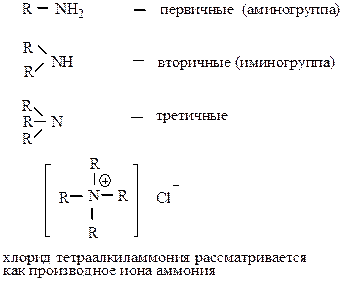 |
1) В зависимости от числа замещенных атомов водорода
2) по природе радикала
- предельные
- непредельные
- циклопарафины
- ароматические
3) по количеству аминогрупп
- моно-
- диамины (первично-вторичные и т.д.)
Радикальная – предусматривает перечисление в названии амина всех радикалов связанных с атомом азота с добавлением окончания - амин.
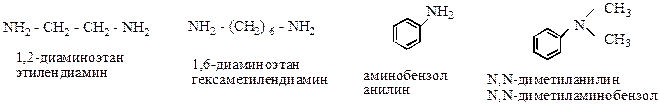
Систематическая – требует строить название амина как производного углеводорода к названию которого добавляют окончание –амин. При этом как всегда выбирают наиболее длинную цепь и указывают положение в ней атома азота.
Ариламины и амины с двумя, тремя и большим числом NH2-групп рассматриваются как аминопроизводные углеводородов.
Низшие алифатические амины – бесцветные, горючие газы. Летучие амины имеют рыбный запах
Ариламины – бесцветные жидкости, при окислении постепенно темнеют. Ядовиты.
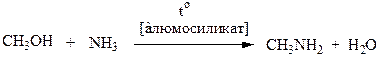 |
Промышленные способы:
1. Алифатические: Взаимодействие спиртов с аммиаком:
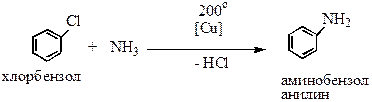 |
Образуется смесь аминов. Процесс регулируется температурой и катализатором
2. Ароматические:
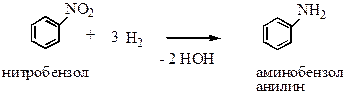 |
Лабораторные:
3.
4. Восстановление амидов, нитрилов, перегруппировка Гофмана (из амидов)
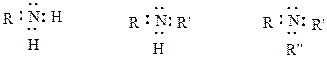
Строение и основность
Электроные формулы аминов:
Как и в аммиаке, в аминах атом азота имеет неподеленную пару электронов и, следовательно, может присоединять катион водорода (протон), проявляя свойства оснований.
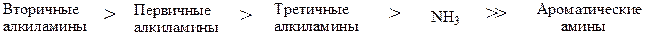
Амины являются единственным классом органических соединений, обладающих заметной основностью. Однако амины – слабые основания. Основность убывает в ряду:
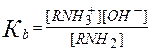 |
Мерой основности вещества является константа основности Кb. Т.к. вода присутствует в большом избытке, то:
Значения Кb для некоторых аминов:
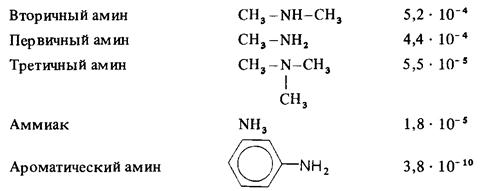 |
Более высокая основность вторичных аминов по сравнению с первичными объясняется тем, что алкильные группы, благодаря наличию у них положительного индукционного эффекта (+I), подают электроны по s-связям на атом азота, что облегчает обобществеление неподелённый пары электронов. Две алкильные группы подают электроны на атом сильнее, чем одна, поэтому вторичные амины являются более сильными основаниями. Исходя из этого, можно было бы ожидать, что третичные амины – еще более сильные основания, чем вторичные. Однако это характерно только для газовой фазы, а в водном растворе основность третичных аминов не столь велика. Это объясняется эффектами сольватации.
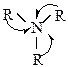 Пространство вокруг атома азота занято алкилами и стабилизация н нем положительного заряда затрудняется молекулами растворителя. Амины проявляют свои свойства при взаимодействии с протоном в растворе. Стерические затруднения за счет трех радикалов снижают эту возможность.
Пространство вокруг атома азота занято алкилами и стабилизация н нем положительного заряда затрудняется молекулами растворителя. Амины проявляют свои свойства при взаимодействии с протоном в растворе. Стерические затруднения за счет трех радикалов снижают эту возможность.
Ароматические амины - очень слабые основания, т.к. неподеленная пара электронов азота (которая и определяет основные свойства аминов) взаимодействует с p-электронным облаком ароматического ядра и вследствие этого менее доступна для протона.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 734; Нарушение авторских прав?; Мы поможем в написании вашей работы!