
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Выражение химического потенциала компонента идеального газа
Уравнение Гиббса-Дюгема
Напишем полный дифференциал внутренней энергии из определения (8.7)
dU = TdS + SdT – pdV – Vdp + 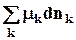 +
+ 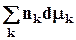 .
.
Подставим в него фундаментальное уравнение Гиббса (8.1):
TdS – pdV + 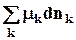 = TdS + SdT – pdV – Vdp +
= TdS + SdT – pdV – Vdp + 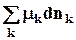 +
+ 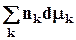 Þ
Þ
SdT – Vdp + 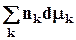 = 0, (8.13)
= 0, (8.13)
или с учетом других видов полезной работы
SdT – Vdp + 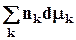 + SXidYi = 0. (8.14)
+ SXidYi = 0. (8.14)
Уравнения (8.13) и (8.14) называются уравнениями Гиббса-Дюгема, неза-
висимыми переменными в них служат интенсивные характеристики. Оно показывает, что изменение интенсивных параметров системы связано между собой: изменение одного интенсивного параметра влечет за собой изменение другого, например, повышаете температуру – изменяются давление и химические потенциалы компонентов, и т.д. Таким образом для определения состояния системы нельзя использовать одни интенсивные параметры, нужно задать хотя бы один экстенсивный.
Если T,p = const, то уравнение Гиббса - Дюгема приобретает вид
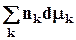 = 0. (8.15)
= 0. (8.15)
Это означает, что химические потенциалы веществ в системе, связаны между собой. Последнее уравнение играет большую роль в теории растворов.
8.5.1. Чистое вещество в закрытой системе (n = const)
m = G/n = G.
dG = - S dT + V dp, при постоянной температуре dGT = V dp. (8.16)
Проинтегрируем последнее выражение от некоторого стандартного состояния до заданного с учетом уравнения Менделеева - Клапейрона
V = RT/p.
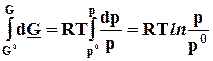 Þ
Þ
G T= G 0T + RT ln p/p0 Þ mT = m0T + RT ln р, (8.17)
(8.17)
где р = p/p˚ -приведенное давление, т.е. отнесенное к стадартному.
Так как p0 = 1 атм, то его часто опускают, но надо помнить, что под логарифмом не может стоять размерная величина, а только относительное давление (или приведенное к стандартному давлению). При постоянной температуре химический потенциал пропорционален логарифму приведенного давления, а m0T - это стандартный химический потенциал идеального газа при заданной температуре (и давлении = 1 атм)
|
|
Дата добавления: 2013-12-12; Просмотров: 399; Нарушение авторских прав?; Мы поможем в написании вашей работы!