
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общее условие химического равновесия в закрытой системе
|
|
|
|
Химические реакции и химическое равновесие
В химической реакции происходит изменение числа молей компонентов в соответствии со стехиометрическим уравнением 0 =S nkAk. Этим системы с химическими реакциями напоминают открытые системы, которые обмениваются веществом с окружающей средой, поэтому полные дифференциалы характеристических функций следует записывать как для открытых систем, например, dG = - SdT + Vdp + Smkdnk.
При p,T = const dGр,Т = Smk dnk. (9.1)
Так же будут выглядеть дифференциалы других характеристических функций при постоянных значениях их естественных параметров. В самопроизвольных процессах при p,T = const энергия Гиббса должна убывать dGр,Т< 0, а в состоянии равновесия достигать минимального значения dGр,Т=0. Следовательно, в самопроизвольной химической реакции при p,T = const Smk dnk < 0. Но
В самопроизвольном процессе при p,T = const производная по степени протекания химической реакции должна убывать, а в состоянии химического равновесия равняться 0:
В принципе химическое равновесие можно выражать через любую характеристическую функцию, но наиболее просто это можно сделать через энергию Гиббса.
DrGpT = Smk nk = S G k∙ nk = S G j∙ nj - Sçni ç∙ G i = 0. (9.4)
Величина 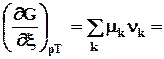 DrGpT показывает изменение энергии Гиббса за 1 пробег (
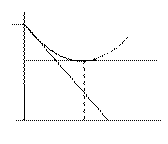
DrGpT показывает изменение энергии Гиббса за 1 пробег ( =1), т.е. при полном превращении реагентов в продукты в мольных количествах, соответствующих стехиометрическим коэффициентам, при р,T = const и заданном составе системы по сравнению с равновесным состоянием, для которого DrGpT = 0. П оэтому ее можно рассматривать как меру химической неравновесности системы, а -DrGpT называют химическим сродством. На графике 9.1 эта величина определяет угловой коэффициент наклона касательной. По мере увеличения химической переменной этот коэффициент уменьшается в связи с изменением состава реакционной смеси, достигая нуля при равновесии.
=1), т.е. при полном превращении реагентов в продукты в мольных количествах, соответствующих стехиометрическим коэффициентам, при р,T = const и заданном составе системы по сравнению с равновесным состоянием, для которого DrGpT = 0. П оэтому ее можно рассматривать как меру химической неравновесности системы, а -DrGpT называют химическим сродством. На графике 9.1 эта величина определяет угловой коэффициент наклона касательной. По мере увеличения химической переменной этот коэффициент уменьшается в связи с изменением состава реакционной смеси, достигая нуля при равновесии.
 ξ
ξ
Рис. 9.1. Химическое сродство.
Поскольку нет возможности определить абсолютное значение энергии Гиббса какого-либо вещества, вводится понятие изменение ее в реакции образования (так же как энтальпии), т.е. получения данного соединения из простых веществ.
Тогда DrGpT = S Df G k∙ nk = SDf G j∙ nj - Sçni ç∙Df G i = 0. (9.5)
Для простых веществ Df G˚ = 0.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 402; Нарушение авторских прав?; Мы поможем в написании вашей работы!