
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гомогенные газовые реакции
|
|
|
|
Уравнение изотермы химической реакции
Уравнение изотермы химической реакции определяет изменение энергии Гиббса за один пробег (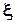 =1) химической реакции при постоянной температуре и давлении. Для выявления факторов, влияющих на эту величину подставим в уравнение (9.4) выражения для химического потенциала
=1) химической реакции при постоянной температуре и давлении. Для выявления факторов, влияющих на эту величину подставим в уравнение (9.4) выражения для химического потенциала
m = m0 + RT ln p (идеальный газ), m = m0 + RT ln f/f˚ (реальный газ) Þ
DrGpT = S(m0k + RT ln pk) nk = Smоknk + RT ln 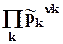 =
=
DrGpT = DrGT0+ RT ln 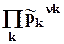 = DrGT0+ RT ln kp. = DrGT0 + RT ln
= DrGT0+ RT ln kp. = DrGT0 + RT ln 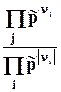 . (9.6)
. (9.6)
Для реальных газов вместо давления в уравнении изотермы будет стоять летучесть
DrGpT = DrGT0 + RT ln 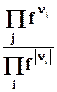 = DrGT0+ RT ln
= DrGT0+ RT ln 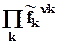 = DrGT0+ RT ln kf. (9.7)
= DrGT0+ RT ln kf. (9.7)
Под знаком логарифма стоят произвольные парциальные давления, которые можно изменять как угодно, но которые поддерживаются постоянными. Произвольные парциальные давления удобнее выражать в атмосферах, тогда они будут приведены к стандартному значению, чтобы под логарифмом стояла безразмерная величина.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 456; Нарушение авторских прав?; Мы поможем в написании вашей работы!