
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
N влияние природы реагирующих веществ
|
|
|
|
Химическая кинетика Л№6
Химическая кинетика — это учение о скорости и механизме химических реакций.
Скорость химической реакции — это количество элементарных актов взаимодействия в единицу времени в единице объёма [для гомогенной среды] или на единице поверхности раздела фаз [в гетерогенной среде].
n
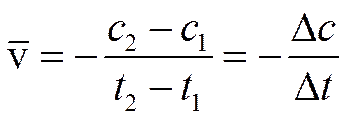 |
n
n
n
n
n
n
n
n
n
n
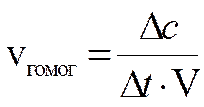 | 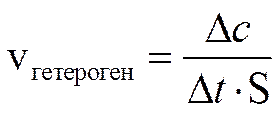 | ||
n
n
n
n
n
n
n
n Скорость гомогенной реакции зависит от:
n - природы реагирующих веществ;
n - концентрации реагентов;
n - температуры;
n - катализатора.
n -----их состава (фтор и иод),
-----вид частиц, которые участвуют в реакции: атомы, молекулы, ионы или радикалы.
ВЛИЯНИЕ КОНЦЕНТРАЦИИ РЕАГЕНТОВ -
• законом действующих масс (1867 г. К.М.Гульдберг и П.Вааге.):
• Скорость простой гомогенной реакции при постоянной температуре пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, численно равные их стехиометрическим коэффициентам.
• aA + bB = dD
• v = K • CА a • CВ b,
• где К — константа скорости -численно равна скорости при концентрации в-в равной 1 моль/л.
• Константа скорости реакции
• ---не зависит от концентрации,
• ----зависит от природы реагирующих веществ,
• температуры,
• катализатора.
• В случае гетерогенных реакций в уравнения закона действующих масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе. Например, для реакции горения угля:
• С + О 2 = СО 2 v = K[O 2 ]
• [концентрация твёрдого вещества входит в константу скорости].
• Молекулярность — это минимальное число различных частиц, участвующих в элементарном акте химического взаимодействия.
• СН 4 → С + 2Н 2 -мономолекулярная
• Н 2 + I 2 → 2HI - би
• 2KMnO 4 + 5H 2 C 2 O 4 + 3H 2 SO 4 → K 2 SO 4 + 2MnSO 4 + 8H 2 O + 10CO 2 три
• Порядок реакции — это сумма показателей степеней в математическом выражении закона действия масс:
• aA + bB = dD
• v = K • CА a • CВ b,
• n = a + b … — общий порядок реакции.
• Показатель степени при какой-либо одной концентрации определяет порядок реакции по данному компоненту. Например, а — показывает порядок реакции по компоненту А и т.д.
• Различают реакции I порядка: С + О 2 = СО 2 v = K[O 2 ]
• В реакциях II порядка скорость:
• H 2 + I 2 = 2HI v = K[H 2 ][I 2 ] уравнение II порядка: 1 + 1 = 2
• 2Н 2 О ↔ 2Н 2 + О 2 v = K[H 2 O] 2
• прямая реакция II порядка, а обратная — III порядка: v = K[H 2 ] 2 [O 2 ] 2 + 1 = 3
• Реакция III порядка в газовой фазе — окисление оксида азота [II]:
• 2NO + O 2 → 2NO 2
• Катализатор повышает порядок реакций, например:
• v = K 1 • [Н 2 О 2 ] • [кат.] 1 + 1 = 2
Влияние температуры:
• Правило Вант-Гоффа [1884] читается так:
• 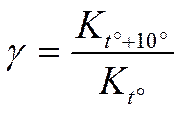 При повышении температуры на 10˚ скорость химической реакции увеличивается в 2-4 раза.
При повышении температуры на 10˚ скорость химической реакции увеличивается в 2-4 раза.
v t2 — скорость реакции при конечной температуре;
v t1 — скорость реакции при начальной температуре;
γ — температурный коэффициент, зависящий от природы реагирующих веществ
K t˚ — константа скорости при t˚,
K t˚+10˚ — константа скорости при t˚+10˚.
n В 1889 г. С.Аррениус предположил, что влияние температуры сводится к увеличению числа активных молекул
n где
n К — константа скорости реакции;
n е — основание натуральных логарифмов,
n Т — абсолютная температура,
n R — газовая постоянная;
n Еакт — энергия активации [кДж/моль],
n А — предэкспоненциальный множитель или коэффициент, равный общему числу соударений за единицу времени в единице объёма.
n Для ионных реакций энергия активации мала [менее 40 кДж/моль], для синтеза аммиака она высока [выше 120 кДж/моль],
n Активированный комплекс — конфигурация атомов, в которой ослаблены старые связи и образуются новые [синтез йодистого водорода]:
n H I H …… I H—I
n | + | → ¦ ¦ →
n H I H …… I H—I
n Энергия активации — это минимальная энергия, достаточная для осуществления акта химического взаимодействия. Энергия активации необходима для возникновения непрочного переходного комплекса
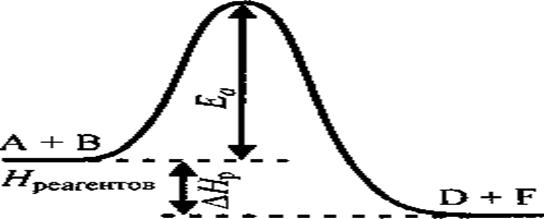
n Катализом называется явление изменения скорости реакции под воздействием небольших добавок специфических веществ, количество которых в ходе реакции не изменяется.
n Характерными признаками катализаторов являются следующие:
n 1. Действие катализаторов строго специфично.
n Al 2 O 3 C 2 H 4 + 2H 2 O
C 2 H 5 OH
n Cu CH 3 —C=O + H 2
n
n H
n 2. Неизменность количества катализатора и его химического состава к концу реакции.
n 3. Количество катализатора незначительно по сравнению с количеством реагирующих веществ.
n 4. Константа равновесия в обратимых реакциях не изменяется. Катализаторы не смещают химического равновесия, они в равной степени влияют и на прямую и на обратную реакцию.
n По влиянию на скорость реакции
n 1.Положительный катализ увеличивает скорость реакции [пример: горение сахара в присутствии солей лития ускоряется].
n 2. Отрицательный катализ уменьшает скорость реакции [пример: ионы Hg 2+ замедляют реакцию:
n 2KIO 3 + 5Na 2 SO 3 + H 2 SO 4 = I 2 + 5Na 2 SO 4 + K 2 SO 4 + H 2 O ].
n вещества, которые усиливают действие катализатора — промоторы, активаторы [для платины промоторами являются железо, алюминий, оксид кремния];
n Вещества, понижающие активность катализатора, - каталитические яды [мышьяк, сероводород, синильная кислота отравляют платину].
n По различным механизмам катализа различают:
n 1. Гомогенный.
n 2. Гетерогенный.
n 3. Микрогетерогенный.
n 4. Аутокатализ.
n 5. Катализ в скрытой форме.
n 6. Ферментативный.
n Влияние катализатора:
n Кат. образует с реагентами промежуточные, реакционноспособные соединения А…Кат, А…Кат…В, которые в дальнейшем превращаются в продукты реакции (Д) и свободный катализатор:
n Механизм гетерогенного катализа различен. в присутствии MnO 2:
n 2KClO 3 = 2KCl + 3O 2
n 1/ 2KClO 3 + 4MnO 2 = 2KCl + 2Mn 2 O 7
n 2/ 2Mn 2 O 7 = 4MnO 2 + 3O 2
n Разновидностью гетерогенного катализа является микрогетерогенный катализ, когда катализатор находится в коллоидном состоянии [ВМС] — ферменты.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 768; Нарушение авторских прав?; Мы поможем в написании вашей работы!