
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
N —число электронов, участвующих в элементарной реакции,
|
|
|
|
T – температура в градусах Кельвина,
F – число Фарадея (заряд электронов количеством 1 моль,
96500 кл/моль),
С(Ox) и С(Red) – молярные концентрации окисленной (oxidation) и восстановленной (redaction) форм веществ, входящие в состав полуэлементов; x, y – соответствующие стехиометрические коэффициенты в уравнении реакции.
При подстановке в данное уравнение Т = 298 К, F = 96500 Кл/моль и замене ln ® lg
получим следующее уравнение:
φ = φ0 + 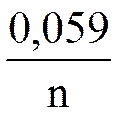
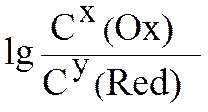
Уравнение Нернста для металлического электрода имеет вид
φ = φ0 + 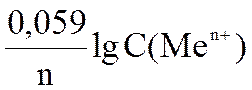 . (6.2)
. (6.2)
Величина электродного потенциала – это количественная характеристика окислительно-восстановительных свойств веществ.
Чем больше алгебраическая величина электродного потенциала, тем большими окислительными свойствами обладает окисленная форма и тем меньшими восстановительными – восстановленная форма вещества.
Согласно уравнению Нернста разность потенциалов двух полуэлементов может возникнуть также в тех случаях, когда они образованы одинаковыми металлами, но с различными концентрациями электролитов. Такие гальванические элементы называются концентрационными.
5 Элементы
Разработано много вариантов гальванических элементов, применяемых на практике; из них наиболее распространенным являются марганцево-цинковый элемент, схема устройства которого показана на рисунке 3.
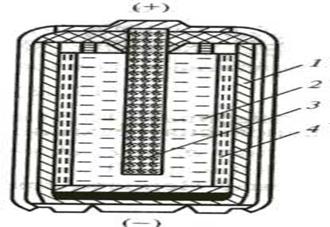
Рисунок 3 Схема марганцево-цинкового элемента
1 – анод (корпус, изготовленный из цинка);
2 – катод (диоксид марганца в смеси с графитовым порошком, для увеличения электропроводности);
3 – токоотвод из графита;
4 – электролит (паста из хлорида аммония в смеси с
загустителем (крахмал или др.).
Реакции на электродах:
Анод (–): Zn - 2e = Zn2+, далее: Zn2+ + 4NH4+ = [Zn(NH3)4]2+ + 4H+,
Катод (+): MnO2 + H+ + e– = MnO(OH).
Реакции в растворе электролита:
[Zn(NH3)4]2+ + 2H+ + 4Сl- = [Zn(NH3)4] Сl2 + 2HСl.
Суммарное уравнение:
2Zn + 4MnO2 + 4NH4Cl = [Zn(NH3)4]Cl2 +ZnCl2 + 4MnO(OH).
ЭДС данного элемента имеет значение –
ЛЕКЦИЯ № 10
«ЭЛЕКТРОЛИЗ»
Если во внешнюю цепь гальванического элемента подключить источник постоянного тока с ЭДС превышающей электродвижущую силу соответствующего гальванического элемента, но с противоположной полярностью, то должна протекать обратная окислительно-восстановительная реакция. На практике ЭДС внешнего источника тока должна быть больше на величину перенапряжения.
Еэлектролиза = Егальван. элемента + Еперенаприжения.
Электролиз – окислительно-восстановительная реакция, протекающая в растворе или расплаве электролита под действием внешнего источника тока.
Электролиз широко используется для получение металлов (алюминий, щелочные и щелочноземельные металлы и другие); рафинирования (очистки) металлов; гальванопластики – получение точных металлических копий и гальваностегии – нанесение на поверхность металлических изделий слоев других металлов; электрохимической обработки поверхностей металлов и других процессов.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 670; Нарушение авторских прав?; Мы поможем в написании вашей работы!