
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электролиз расплавов
|
|
|
|
Раздерем данный вопрос на следующих примерах:
1) Электролиза расплава NaCl с инертными электродами.
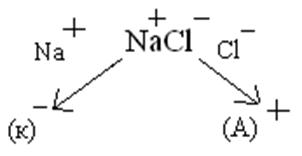 К) Na
К) Na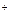 + e = Na
+ e = Na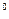 , А) 2Сl
, А) 2Сl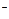 - 2e = Сl
- 2e = Сl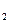 .
.
На катоде идет процесс восстановления, а на аноде – окисления.
При электролизе данного соединения получается металлический натрий и свободный хлор.
2) Химизм промышленного получение алюминия.
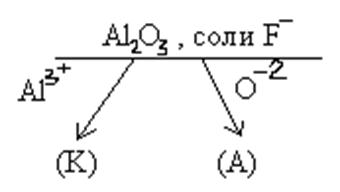
К) Аl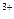 + 3e = Аl
+ 3e = Аl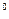 , a) 2О
, a) 2О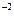 - 4e = О2.
- 4e = О2.
Температура плавления оксида алюминия около 2050 0С. Для снижения температуры плавления электролита до 960 0С электролизу подвергают смесь оксида алюминия (10% по массе) с криолитом (Nа[АlF6]). Алюминий, имеющий большую плотность чем электролит, собирается на дне электролизера.
2 Электролиз водных растворов
В случае водных растворов наблюдается конкуренция между ионами растворенного вещества и воды за процесс окисления и восстановления. При этом следует учитывать, что металл анода тоже может окисляться – растворимый анод. К нерастворимым анодам относятся: углерод, золото, платина, свинец в растворе серной кислоты и др.
Последовательность разрядки водных растворов ионов в ходе электролиза согласуется со следующей схемой:
1) Катионы:
– от лития до Аl не восстанавливаются, так как идет электролиз воды;
– от Мn до водорода – наряду с восстановлением металла идет восстановление воды;
– металлы после водорода – идет практически полное восстановление металла.
2) Анионы:
– анод растворимый – вначале происходит окисление металла анода;
– анод нерастворимый – вначале окисляются анионы бескислородных кислот (I-, Вr-, Cl-) за исключением F- , далее идет окисление ОН- и Н2О и затем окисляются анионы кислородсодержащих кислот (SO42–, NO3– и др.) и F-.
Разберем различные случаи электролиза водных растворов:
1) Электролиз водного раствора NaCl с инертными электродами.
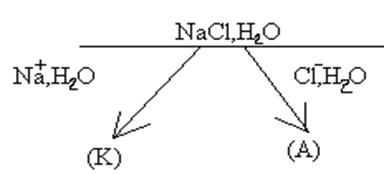
К) 2Н2О + 2e = Н2 + 2ОН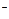 , А) 2Сl
, А) 2Сl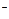 - 2e = Сl2.
- 2e = Сl2.
Вторичная реакция в ходе электролиза — Na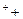 ОН
ОН = NaОН.
= NaОН.
Таким образом в ходе электролиза водного раствора NaОН с инертными электродами образуются: Н2, Сl2 и NaОН.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 617; Нарушение авторских прав?; Мы поможем в написании вашей работы!