
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Степень окисления элементов в соединениях
|
|
|
|
Окислительно-восстановительные реакции
Электрохимия
Модуль 4
В большинстве химических реакций происходит перемещение электронов от одних частиц к другим. Такие реакции называют окислительно-восстановительными.
Для характеристики состояния элементов в соединениях введено понятие степени окисления. Число электронов, смещенных от атома данного элемента или к атому данного элемента в соединении, называют степенью окисления. Положительная степень окисления обозначает число электронов, которые смещаются от данного атома, а отрицательная степень окисления — число электронов, которые смещаются к данному атому. Из этого определения следует, что в соединениях:
- с неполярными связями степень окисления элементов равна нулю. Примерами таких соединений служат молекулы, состоящие из одинаковых атомов (С12, Н2). Степень окисления металлов в элементном состоянии равна нулю, так как распределение электронной плотности в них равномерно;
-в простых ионных соединениях степень окисления входящих в них элементов равна электрическому заряду, поскольку при образовании этих соединений происходит практически полный переход электронов от одного атома к другому:
+2 -1 +1 +5 -1
Са С12, К N О3;
- при определении степени окисления элементов в соединениях с полярными ковалентными связями сравнивают значения их электроотрицательностей. Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления. Фтор, характеризующийся наибольшим значением электроотрицательности, в соединениях всегда имеет постоянную отрицательную степень окисления -1. Для кислорода, также имеющего высокое значение электроотрицательности, характерна отрицательная степень окисления обычно -2, в пероксидах -1. Исключение составляет соединение ОF2, в котором степень окисления кислорода +2.
- щелочные и щелочноземельные элементы, для которых свойственно относительно невысокое значение электроотрицательности, всегда имеют положительную степень окисления, равную соответственно +1 и +2.
- постоянную степень окисления (+1) в большинстве соединений проявляет водород, например
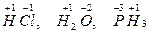
Однако в гидридах металлов степень окисления водорода -1, например
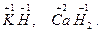
Понятие степени окисления для большинства соединений имеет условный характер, так как не отражает реальный эффективный заряд атома. Однако это понятие весьма широко используется в химии.
Большинство элементов могут проявлять разную степень окисления в соединениях. При определении их степени окисления пользуются правилом, согласно которому сумма степеней окисления элементов в электронейтральных молекулах равна нулю, а в сложных ионах – заряду этих ионов. В качестве примера рассчитаем степень окисления азота в соединениях NаNО2 и НNО3. Степень окисления водорода и щелочных металлов в соединениях равна +1, а степень окисления кислорода -2. Соответственно степень окисления азота равна
NаNО2 1+ х + 2(-2) = 0, х = +3
NО3 1+ х + 3(-2) = 0, х = +5
Аналогичным способом можно определить степень окисления элементов в любых соединениях.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 519; Нарушение авторских прав?; Мы поможем в написании вашей работы!