
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Произведение растворимости. Носителями кислотных свойств являются ионы H+, а щелочных ионы ОН-
|
|
|
|
Водородный показатель
Носителями кислотных свойств являются ионы H+, а щелочных ионы ОН-. Когда
[Н+] = [ОН-] - раствор нейтральный;
[Н+] > [ОН-] - раствор кислый;
[Н+] < [ОН-]- - раствор щелочной.
Для характеристики кислотности среды введен специальный параметр - водородный показатель или рН. Водородным показателем или рН называют взятый с обратным знаком десятичный lg концентрации [Н+] в растворе:
рН = - lg [Н+] (4.25)
Водородный показатель введен датским химиком Серенсом в 1901г. рН характеризует реакцию раствора. При 295К
рН=7 ([Н+]= 10-7 моль/л) раствор нейтральный;
рН<7 ([Н+]>107 моль/л) раствор кислый;
рН>7([Н+] <107 моль/л) - раствор щелочной.
С повышением температуры меняется рН. При 353К у нейтрального раствора рН=6,3.
Величина рН может служить критерием силы кислоты или основания. Из 2-х кислот более сильной будет та, у которой при одинаковой молярной концентрации концентрация [Н+] выше (рН ниже). Для оснований зависимость носит обратный характер.
Для определения реакции среды используют индикаторы. Индикаторы – слабые органические кислоты или основания у которых недиссоциированные молекулы и ионы имеют различную окраску. Ниже приведены значения рН некоторых составляющих нашего организма.
кровь желудочный сок слюна слеза
рН 7,4 1,7 6,9 7.
Большинство веществ малорастворимы в воде, поэтому очень часто имеют дело с системами, в которых в состоянии равновесия находятся осадок и насыщенный раствор электролита. Это равновесие носит динамический характер, вследствие чего скорость процесса растворения осадка должна совпадать со скоростью его кристаллизации.
Равновесие в насыщенном растворе электролита AmВn можно представить так:
АmBn D mAn+ + nBm-
Прямой процесс - это растворение осадка, а обратный процесс - это кристаллизация осадка из насыщенного раствора.
Процессы растворения и кристаллизации, которые происходят в этой системе, происходят на поверхности осадка, т. е. система гетерогенна.
Данный гетерогенный процесс можно охарактеризовать следующей константой равновесия:
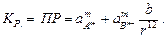 (4.26)
(4.26)
Константа равновесия данного процесса представляет собой произведение активностей катионов водорода и гидроксид-анионов.
Произведение активностей ионов малорастворимого электролита, содержащегося в его насыщенном растворе при данной температуре, есть величина постоянная, и называется произведением растворимости.
CaSO4 ↔ Ca2+ + SO42-
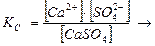
KC [CaSO4] = [Ca2+] [SO42-] = ПР
ПР (CaSO4 ) = 9,3·10-9.
Произведение растворимости зависит от природы растворенного вещества и растворителя, а также от температуры и не зависит от активности ионов малорастворимого электролита в растворе.
Произведение растворимости для наиболее важных электролитов рассчитано и содержится в таблицах. Зная произведение растворимости, можно вычислить, выпадает ли в данных условиях вещество в осадок. Условием образования осадка малорастворимого электролита является превышение произведения активностей ионов этого электролита в растворе над табличной величиной произведения растворимости.
Если активность или концентрация одного из ионов малорастворимого электролита увеличится, то равновесие сместится, и, соответственно, активность или концентрация другого иона уменьшится.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 335; Нарушение авторских прав?; Мы поможем в написании вашей работы!