
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы выражения концентрации растворов
|
|
|
|
Химические свойства.
1. Термическое разложение.
[Cu(OH)]2CO3(малахит) = 2CuO + CO2 + H2O
ГЕНЕТИЧЕСКАЯ СВЯЗЬ
МЕЖДУ РАЗЛИЧНЫМИ КЛАССАМИ СОЕДИНЕНИЙ

|
Примеры
1. металл + неметалл = соль
Hg + S = HgS
2Al + 3I2 =2AlI3
2. основной оксид + кислотный оксид = соль
Li2O + CO2 =Li2CO3
CaO + SiO2= CaSiO3
3. основание + кислота = соль
Cu(OH)2 + 2HCl = CuCl 2 + 2H2O
4. металл + кислород = основной оксид
2Ca + O2 = 2CaO
4Li + O2 = 2Li2O
5. неметалл + кислород = кислотный оксид
S + O2 = SO2
4As + 5O2 = 2As2O5
6. основной оксид + вода = основание
BaO + H2O = Ba(OH)2
Li2O + H2O = 2LiOH
7. кислотный оксид + вода = кислота
P2O5 + 3H2O = 2H3PO4
SO3 + H2 O = H2SO4
Модуль 4. Растворы ……………………………………………………………
4.1. Химическое равновесие в растворах …………………………………….
4.1.6. Способы выражения концентрации растворов…………………………
Под концентрацией понимают отношение количества (моль) или массы вещества, содержащегося в растворе, к объему или массе раствора либо растворителя.
Способов выражения концентрации растворов несколько.
1. Массовая доля – это отношение массы растворенного вещества к массе раствора
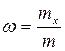 , (4.4)
, (4.4)
где mx– масса вещества х, г; m– масса раствора, г;
Массовая доля обычно выражается в процентах и показывает сколько граммов данного вещества содержится в 100г раствора.
2. Молярная концентрация. Молярность раствора СМ определяется числом молей растворённого вещества, содержащихся в одном литре раствора:
 →
→  , [моль/л] или [М], (4.5)
, [моль/л] или [М], (4.5)
где Мх – молярная масса вещества х; ρ – плотность раствора.
3. Молярная концентрация эквивалента (нормальность) определяется числом моль - эквивалентов растворенного вещества в 1л раствора:
 , [моль/л] или [н] (4.6)
, [моль/л] или [н] (4.6)
где nэ - числом моль-эквивалентов растворенного вещества; Mэ – молярная масса эквивалента.
Молярная масса эквивалента кислоты (H2SO4) равна отношению ее молярной массы к основности (числу атомов водорода в формуле кислоты):
 г.
г.
Молярная масса эквивалента основания (Ca(OH)2) равна отношению ее молярной массы к кислотности (числу гидроксильных групп в формуле основания):

Молярная масса эквивалента соли (Fе2 (SО4) 3) равна отношению ее молярной массы к произведению валентности металла и числу атомов металла):

Моляльность раствора Сm определяется числом молей, содержащихся в 1000 г растворителя (Н2O):
 [моль/кг]. (4.7)
[моль/кг]. (4.7)
4. Титр раствора определяется количеством граммов растворенного вещества в 1 мл раствора:
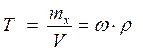 [г/мл]. (4.8)
[г/мл]. (4.8)
4.2. Водные растворы электролитов ………………………………………….
4.2.1. Электролитическая диссоциация…………………………………………
4.2.2. Растворы электролитов. Степень
электролитической диссоциации……………………………………………….
4.2.3. Слабые электролиты. Константа диссоциации………………………….
4.2.4. Закон разведения Оствальда……………………………………………….
4.2.5. Ионное произведение воды……………………………………………..
4.2.6. Водородный показатель…………………………………………………
4.2.7. Произведение растворимости.…………………………………………..
4.2.8. Смещение равновесия в растворах электролитов……………………..
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 343; Нарушение авторских прав?; Мы поможем в написании вашей работы!