
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы электролитов. Степень электролитической диссоциации
|
|
|
|
Электролитическая диссоциация
Водные растворы электролитов
Аррениус обратил внимание на способность растворов кислот, оснований, солей проводить электрический ток. Это связано с тем, что при растворении имеет место электролитическая диссоциация. Такие растворы называются растворами электролитов.

или упрощенно
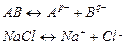
При диссоциации ионных кристаллов имеет место ион-дипольное взаимодействие с диполями растворителя. Взаимодействие при диссоциации полярных молекул – диполь-дипольное.
Не только вода, но и др. жидкости, состоящие из полярных молекул (этиловый спирт) являются ионизирующими растворителями, т.е. в них происходит диссоциация.
Растворы электролитов проводят электрический ток и являются проводниками второго рода.
Для растворов электролитов в уравнение Вант-Гоффа вводится поправочный коэффициент
р = iCRT,
где i - изотонический коэффициент, характеризующий отклонение от законов идеальных растворов вследствие электролитической диссоциации электролитов.
DТкип = i КЭ ·n, DТзам = i Кк·· n,
Фактическое понижение DТзам и повышение DТкип значительно отличается от расчетных значений.
Степень диссоциации электролита - это отношение числа диссоциированных на ионы молекул n к общему числу молекул растворенного электролита N. т.е.
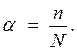 (4.13)
(4.13)
В зависимости от степени диссоциации электролита различают слабые и сильные электролиты.
1. Для сильных электролитов  > 0,3.
> 0,3.
К сильным электролитам относятся все щелочи, гидроксиды щелочноземельных металлов такие кислоты как НС1, Н2SO4, большинство нейтральных солей.
2. Для слабых электролитов  < 0,3.
< 0,3.
Это большинство органических кислот, неорганические слабые кислоты (НСN, Н2CO3), амфотерные гидроксиды (Al(OH)3, Zn(OH)2), гидроксиды f- и d-элементов, некоторые нейтральные соли (CdCl2). Особенно слабыми электролитами являются вода, сероводород, синильная и борная кислоты.
3. Средние электролиты находятся между слабыми и сильными электролитами. Это соли тяжелых металлов, а также некоторые органические кислоты: лимонная, щавелевая, муравьиная.
При составлении уравнений в ионном виде только сильные электролиты записывают в виде ионов. Вода не расписывается в виде ионов.
Степень диссоциации зависит от природы электролита и растворителя, а также от температуры и концентрации электролита. С уменьшением концентрации степень диссоциации увеличивается, а при сильном разведении раствора  —>1, и различия между сильно и слабо диссоциирующими электролитами сглаживаются.
—>1, и различия между сильно и слабо диссоциирующими электролитами сглаживаются.
Степень диссоциации зависит и от диэлектрической проницаемости (e) растворителя: чем больше e, тем сильнее диссоциирует электролит. В воде он может быть сильным, а в ацетоне - слабым (e воды и ацетона равно 80 и 21). По закону Кулона, сила притяжения между разноименно заряженными ионами обратно пропорциональна e.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 320; Нарушение авторских прав?; Мы поможем в написании вашей работы!