
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительные реакции
|
|
|
|
Окислительно-восстановительная реакция состоит из процессов окисления и восстановления. Окисление ‒ это отдача электронов веществом, т. е. повышение степени окисления элемента. В качестве примера рассмотрим реакцию окисления цинка:
Zn - 2е → Zn2+
Степень окисления цинка повышается от 0 до +2. Вещества, отдающие свои электроны в процессе реакции, называют восстановителями. В данной реакции восстановителем является цинк. В результате реакции степень окисления элемента возрастает. Это значит, что вещество из восстановленной формы превращается в окисленную. Для приведенной реакции восстановленной формой вещества будет металлический цинк, а окисленной формой ‒ ионы Zn2+.
Восстановление ‒ это смещение электронов к веществу или понижение степени окисления элемента. Например, реакция восстановления иона Н+
2Н+ + 2е = Н2
Вещество, принимающее электроны, называется окислителем. В данной реакции окислителем будет ион Н+. В результате реакции степень окисления элемента понижается. Поэтому можно сказать, что вещество из окисленной формы превращается в восстановленную.
Раздельное протекание реакций окисления и восстановления происходит лишь в электрохимических процессах. В химических окислительно-восстановительных реакциях окисление и восстановление взаимосвязаны. В ходе окислительно-восстановительной реакции восстановитель отдает свои электроны окислителю. Например, в реакции окисления углерода кислородом электроны перемещаются от углерода к кислороду:
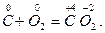
В данной реакции участвуют разные вещества. Реакции, в которых окислители и восстановители представляют собой различные вещества, называют межмолекулярными. В некоторых реакциях окислителями и восстановителями могут быть атомы одной и той же молекулы. Такие реакции называют внутримолекулярными. Обычно это реакции разложения веществ, например
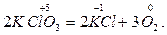
В данной реакции степень окисления кислорода увеличивается (окисление), а степень окисления хлора уменьшается (восстановление). Разновидностью окислительно-восстановительных реакций является диспропорционирование (самоокисление — самовосстановление), при котором происходит окисление и восстановление атомов или ионов одного и того же элемента, например
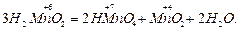
В окислительно-восстановительных реакциях наряду с окислителями и восстановителями могут участвовать ионы или молекулы среды.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 338; Нарушение авторских прав?; Мы поможем в написании вашей работы!