
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химический состав
|
|
|
|
Химические компоненты природных вод по предложению советского ученого О.А. Алекина условно делят на пять групп:
I) главные ионы;
2) растворенные газы;
3) биогенные вещества;
4) органические вещества;
5) микроэлементы.
Главные ионы. Число различных ионов, встречающихся в природных водах, велико, но значительное распространение имеют лишь немногие из них. Наиболее распространенные катионы Na+, Ca2+, Mg2+, анионы HCO3–, SO42-, Cl–. Кроме этих шести главных ионов, распространены также ионы СO32–, HSiO3–, K+, Fe2+. Однако они встречаются обычно в количествах, в десятки и сотни раз меньших, чем содержание шести главных ионов. Основной источник поступления ионов Ca2+ и Mg2+ в воду – растворение пород, содержащих известняки, доломиты, гипс, сложные алюмосиликаты. Наличие гидрокарбонат-иона связано с растворением карбонатных пород под действием диоксида углерода. Сульфат-ионы поступают в природные воды в процессе растворения гипсовых пород, окисления сульфидов, серы и сероорганических соединений. Значительное количество сульфат-ионов имеется в водах атмосферных осадков вследствие загрязнения промышленными выбросами. Ионы K+, Na+, Cl– появляются в природных водах при растворении горных пород, cодержащих хлориды солей. Ионы хлора в большом количестве выбрасываются при извержении вулканов в виде HCl. В значительном количестве хлорид-ионы содержатся в сточных водах.
Концентрация основных ионов в природных водах зависит от степени минерализации. В пресных водах преобладают ионы HCO3–, Ca2+, Mg2+. По мере увеличения общей минерализации растет концентрация SO42–, Cl–, Na+, K+, Mg2+. В высокоминерализованных водах преобладают ионы Cl–, Na+, реже встречаются Mg2+ и очень редко Ca2+.
Согласно классификации, предложенной О.А. Алекиным, природные воды по преобладающему аниону делятся на три класса: гидрокарбонатные, сульфатные и хлоридные. Классы уточняются дальнейшим делением на три группы по преобладающему катиону: кальциевые, магниевые и натриевые. Группы, в свою очередь, подразделяются на типы, указывающие на соотношения между ионами. С глубиной погружения подземных вод минерализация и химический состав их изменяются. Это явление называется гидрохимической зональностью. По мере погружения горизонтов наблюдается увеличение минерализации. Наиболее погруженные подземные воды представляют собой рассолы, минерализация которых достигает несколько сотен граммов на литр. Сверху вниз располагаются зоны гидрокарбонатных, сульфатных и, наконец, хлоридных вод.
Растворенные газы. Все природные воды содержат растворенные газы: азот, кислород, диоксид углерода, водород, сероводород, инертные газы – гелий, аргон. Присутствие углеводородных газов (метана, этана, пропана) связано с нефтеносными и газовыми месторождениями. Газы в подземных водах находятся в виде молекулярных растворов. Количество растворенного газа в воде характеризуется газонасыщенностью, которая выражается в объёмных единицах – см3/л. Газонасыщенность и химический состав растворенных газов также подвержен гидрохимической зональности. В поверхностных водах преобладает азот, кислород, диоксид углерода. В подземных водах, по мере погружения, среди водорастворимых газов появляется сероводород, гелий, углеводородные газы, растет газонасыщенность.
Кислород. Содержание кислорода в природных водах определяется поступлением его из воздуха. Кислород в подземных водах имеет исключительно атмосферное происхождение. В подземных водах кислород расходуется на реакции окисления для жизнедеятельности бактерий. Иногда кислород в природных водах может возникать в результате протекания электрохимических процессов непосредственно на объекте эксплуатации. Содержание в воде кислорода имеет существенное значение при заводнении нефтяных месторождений.
Диоксид углерода. Этот газ находится в воде как в растворенном состоянии, так и в форме угольной кислоты. Находящиеся в воде ионы HCO3–, CO32– и CO2 связаны углекислотным равновесием:
СO2 +H2O H2CO3
H2CO3  H++ HCO3–
H++ HCO3–  2H++ CO32-
2H++ CO32-
Свободный CO2 появляется в природных водах главным образом в результате биохимического окисления органических веществ. В глубинных водах заметно преобладает CO2 неорганического происхождения. Сюда он поступает из магмы, а также в результате разложения карбонатов. В поверхностных водах содержание СО2 обычно составляет 0,5-2, максимум 20-30 мг/л. В подземных водах его концентрация превышает 50 мг/л.
Сероводород. Возникновение сероводорода в водах является преимущественно следствием биохимических процессов разложения органических веществ и восстановления сульфатов. Он образуется также в результате растворения сульфатных минералов под действием угольной кислоты. Сероводород может содержаться в некоторых водах при загрязнении их сточными водами, в частности, сточными водами нефтепромыслов. Кроме растворенного молекулярного сероводорода, в воде могут находиться сульфид S2– и гидросульфид-ионы HS–:
H2 S  H++ HS –
H++ HS – H++ S2–
H++ S2–
рН< 5 рН = 5÷9 рН > 9
Соотношение между ними зависит от pH воды. При pH < 5 в воде находится только сероводород, при рН = 5÷9 в воде присутствует сероводород в равновесии с гидросульфид-ионом. Сульфид-ионы появляются в щелочной среде при рН > 9.
Свободные углекислота и сероводород определяют многие свойства воды, важные при заводнении нефтяных залежей, такие, например, как агрессивное воздействие на цементный камень и металлы, на отложения солей в порах пласта, трубопроводах и запорной арматуре.
Биогенные вещества. К этой группе относят соединения, необходимые для жизнедеятельности организмов и образуемые ими в процессе обмена веществ. Биогенными веществами являются органические и неорганические соединения азота, фосфора, железа и кремния.
Для сравнения химического состава пластовые воды, как и другие природные воды, классифицируют по характерным признакам. Нефтяники нашей страны преимущественно используют классификацию, предложенную В.А. Сулиным. По этой классификации воды подразделяются на четыре типа: I) сульфатно-натриевые; 2) гидрокарбонатно-натриевые; 3) хлоридно-магниевые; 4) хлоридно-кальциевые. Принадлежность воды к определенному типу устанавливается лабораторным анализом соотношения количеств в миллиграмм-эквивалентах (моль-эквивалентах) отдельных ионов (табл. 2).
Классификация природных вод В.А. Сулина по типам Таблица 2
| Тип воды | Соотношение ионов* | ||
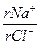
| 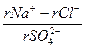
| 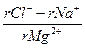
| |
| Сульфатно-натриевый | > 1 | < 1 | < 0 |
| Гидрокарбонатно-натриевый | > 1 | > 1 | < 0 |
| Хлоридно-магниевый | < 1 | < 0 | < 1 |
| Хлоридно-кальциевый | < 1 | > 0 | > 1 |
*– Знак «r» перед ионом означает, что содержание иона выражено в эквивалентной форме.
В свою очередь, каждый тип делится по преобладанию аниона на три группы вод: гидрокарбонатные, сульфатные и хлоридные, а каждая группа включает три подгруппы по преобладанию катиона: натриевые, магниевые и кальциевые.
Наиболее распространенными среди вод нефтяных месторождений являются гидрокарбонатно-натриевые и, особенно, хлоридно-кальциевые воды.
Хлоридно-кальциевые воды характеризуются высокой минерализацией, плотность вод колеблется в широких пределах и достигает 1,2 г/см. В хлоридно-кальциевых водах содержится значительное количество ионов Na+, Cl–, меньше ионов Ca2+ и Mg2+ и ещё меньше CO32–, HCO3–. Воды отдельных месторождений могут содержать большое количество железа (до 300 мг/л).
Гидрокарбонатно-натриевые воды отличаются меньшей минерализацией, плотность редко превышает 1,07 г/см3. Основными компонентами гидрокарбонатно-натриевых вод являются ионы Na+, Cl–. Отличительной особенностью этих вод является незначительное содержание ионов Ca2+.
Данные о химическом составе подземных вод лежат в основе гидрогеохимических методов поиска и разведки нефтяных и газовых месторождений. Прямыми показателями нефтегазоносности является наличие в подземных водах нафтеновых кислот, бензола, фенолов и газов, насыщенных этаном, пропаном, бутаном. Косвенными показателями являются высокая минерализация; низкое содержание сульфат-ионов или полное его отсутствие; наличие хлоридов кальция или гидрокарбоната натрия, высокое содержание иода, брома, бора, иона аммония; повышенная радиоактивность; высокая насыщенность азотом биохимического происхождения и повышенное содержание гелия и диоксида углерода.
Низкое содержание сульфат-иона или полное отсутствие его в водах нефтяных месторождений объясняется тем, что присутствие органического углерода создает восстановительные условия в пласте. В результате этого сульфаты восстанавливаются по уравнению
MeSO4 + 2C0 + H2O = MeCO3 + CO2↑ + H2S↑
Из приведенной реакции следует, что органическое вещество окисляется и превращается в СО2, а сульфаты исчезают из вод, превращаясь в сероводород. Процессу восстановления сульфатов (десульфатизации) способствуют бактерии-десульфатизаторы, живущие в нефти. Эти бактерии используют кислород сульфатов для дыхания, а углеводороды служат им источником питания.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 553; Нарушение авторских прав?; Мы поможем в написании вашей работы!