
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Показатели качества и химический анализ воды
|
|
|
|
При анализе вод для характеристики их свойств определяют химические, физические и бактериологические показатели. Основными показателями, определяющими пригодность воды для определенной отрасли народного хозяйства, являются химические, так как физические (содержание взвешенных частиц, температура, цвет, запах, плотность, сжимаемость, вязкость, поверхностное натяжение) и бактериологические (наличие бактерий) показатели зависят от химического состава воды.
К химическим показателям качества воды относятся:
I) общее солесодержание; 2) жесткость; 3) окисляемость;
4) реакция среды; 5) солевой состав; 6) состав растворенных газов.
Жесткость воды обуславливается наличием в ней ионов Са2+ и Mg2+. Для большинства производств жесткость воды является основным показателем её качества. В жесткой воде плохо пенится мыло. При нагревании и испарении жесткой воды образуется накипь на стенках паровых котлов, труб, теплообменных аппаратов, что ведет к перерасходу топлива, коррозии металлов и авариям.
Жесткость количественно выражается числом миллиграмм-эквивалентов ионов кальция и магния в 1 л воды (мг-экв/л); 1 мг-экв/л жесткости соответствует содержанию в воде 20,04 мг/л ионов Са2+ или 12,16 мг/л ионов Mg2+. Различают жесткость общую, карбонатную и некарбонатную.
Карбонатная жесткость связана с присутствием в воде в основном гидрокарбонатов и карбонатов кальция и магния, которые при кипячении воды переходят в нерастворимые средние или основные соли и выпадают в виде плотного осадка:
Ca(HCO3)=CaCO3↓+H2O+CO2↑
2Mg(HCO3)2=(MgOH)2CO3↓+3CO2↑+H2O
Таким образом, при кипячении жесткость воды как бы устраняется. Поэтому она называется также временной жесткостью. Следует сказать, что при переходе HCO3– в CO32– и при выпадении карбонатов кальция и магния в воде остается некоторое количество ионов Са2+, Mg2+, CO32–, соответствующее произведению растворимости СаСО3 и (MgOH)2CO3. В присутствии посторонних ионов растворимость этих соединений повышается.
Некарбонатная (постоянна я) жесткость не разрушается кипячением. Она обуславливается присутствием в воде кальциевых и магниевых солей сильных кислот, главным образом, сульфатов и хлоридов.
Общая жесткость воды представляет собой сумму карбонатной и некарбонатной жесткости и обуславливается суммарным содержанием в воде растворенных солей кальция и магния. По величине общей жесткости принята следующая классификация природных вод:
очень мягкие (<1,5 мг-экв/л),
мягкие (1,5-3,0 мг-экв/л),
средней жесткости (3,0-5,4 мг-экв/л),
жесткие (5,4-10,7 мг-экв/л),
очень жесткие (>10,7 мг-экв/л).
Если известны концентрации в воде Ca2+, Mg2+ и HCO3–, то жесткость рассчитывается по следующим формулам:
Общая жесткость 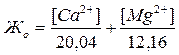
Карбонатная жесткость равна концентрации [HCO3–]; в случае, если содержание ионов кальция и магния в воде выше, чём количество гидрокарбонатов:
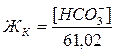 , где 61,02 – эквивалентная масса иона HCO3–.
, где 61,02 – эквивалентная масса иона HCO3–.
Если же количество гидрокарбонатов в воде превышает содержание ионов кальция и магния, то карбонатная жесткость соответствует общей жесткости. Разность между общей и карбонатной жесткостью составляет некарбонатную жесткость: ЖНК = ЖО – ЖК. Следовательно, ЖНК – это содержание Ca2+ и Mg2+, эквивалентное концентраций всех остальных анионов, в том числе и некомпенсированных гидрокарбонатов.
Реакция среды характеризует степень кислотности или щелочности воды. Концентрация водородных ионов природных вод зависит главным образом от гидролиза солей, растворенных в воде, количества растворенных угольной кислоты и сероводорода, содержания различных органических кислот. Обычно для большинства природных вод величина рН изменяется в пределах 5,5-8,5. Постоянство рН природных вод обеспечивается наличием в ней буферных смесей. Изменение значения рН свидетельствует о загрязнении природной воды сточными водами.
Солевой состав. При анализе природных вод определяют содержание в них преимущественно главных ионов: Cl–, SO42–, HCO3–, CO32–, Ca2+, Mg2+, K+, Na+.
Определение ионаCl–. В основу определения иона хлора положен аргентометрический метод Мора. Принцип анализа заключается в том, что при прибавлении к воде раствора AgNO3 образуется белый осадок хлорида серебра:
Cl– + Ag+ = AgCl↓
Определение хлорид-ионов ведут в интервале рН = 6,5 ÷ 10, чтобы одновременно с AgCl не выпадал осадок Ag2CO3. Проведению определения Сl– мешает наличие в воде ионов брома, йода, сероводорода, от которых освобождаются предварительной обработкой воды.
Определение иона SO42–. Метод определения сульфат-ионов основан на малой растворимости сульфата бария, количественно выпадающего в кислой среде при добавлении к воде раствора хлорида бария:
Ba2+ + SO42– = BaSO4↓
По массе образовавшегося осадка рассчитывают содержание иона SO42–
Определение ионов CO32– и HCO3–. Эти ионы определяют титрованием пробы воды растворами серной или соляной кислот последовательно с индикаторами фенолфталеином и метилоранжем. Реакция нейтрализации протекает в две стадии. Первые порции кислоты вступают в реакции с карбонат-ионом, образуя гидрокарбонат-ион:
CO32– + H+ = HCO3–
Окраска фенолфталеина при рН = 8,4 переходит из розовой в бесцветную, что совпадает с таким состоянием раствора, когда в нем остаются лишь гидрокарбонаты. По количеству кислоты, пошедшей на титрование, рассчитывают содержание карбонат-иона. Расход кислот на титрование с фенолфталеином эквивалентен содержанию половины карбонатов, т.к. последние нейтрализуются только наполовину до HCO3– Поэтому общее количество CO32– эквивалентно удвоенному количеству кислоты, затраченной на титрование. При дальнейшем титровании в присутствии метилоранжа происходит реакция нейтрализации гидрокарбонатов:
HCO3– + H+ → CO2 + H2O
Метилоранж меняет окраску при pH = 4,3, т.е. в момент, когда в растворе остается только свободный диоксид углерода.
При расчете содержания ионов HCO3– в воде следует из количества кислоты, пошедшей на титрование с метилоранжем, вычесть количество кислоты, идущей на титрование с фенолфталеином. Общее количество кислоты, затраченной на нейтрализацию ионов ОН–, СО32– и НСО3– характеризует общую щелочность вода. Если рН воды ниже 4,3, то её щелочность равна нулю.
Определение ионов Ca2+, Mg2+. Имеется несколько методов обнаружения и определения содержания ионов Са2+ и Mg2+. При добавлении в воду оксалата аммония (NH4)2C2O4, в случае присутствия ионов кальция образуется белый осадок оксалата кальция:
Ca2+ + C2O42– = CaC2O4↓
После отделения осадка оксалата кальция в воде можно определить ионы Mg2+ с помощью раствора гидрофосфата натрия Na2HPO4 и аммиака. При наличии иона Mg2+ образуется мелкокристаллический осадок соли магния:
Mg2+ + HPO42– + NH3 = MgNH4PO4↓
Полученные осадки прокаливают и взвешивают. На основании полученных результатов вычисляется величина кальциевой и магниевой жесткости.
Наиболее быстрым и точным методом определения Са2+ и Mg2+ является комплексонометрический метод, основанный на способности двунатриевой соли этилендиаминотетрауксусной кислоты (трилон Б)

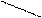 NaOOCCH2 CH2COONa
NaOOCCH2 CH2COONa
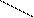
 N––CH2––CH2––N
N––CH2––CH2––N
HOOCCH2 CH2COOH
образовывать с ионами кальция и магния прочные комплексные соединения.
При титровании пробы воды трилоном Б происходит последовательное связывание в комплекс сначала ионов кальция, а затем ионов магния. Содержание ионов кальция определяют, титруя воду в присутствии индикатора-мурексида. Мурексид образует с ионами кальция малодиссоциированное комплексное соединение, окрашен ное в малиновый цвет. Ионы магния не дают комплекса с мурексидом. Трилон Б извлекает Са2+ из его растворимого комплекса с мурексидом, вследствие чего окраска раствора, изменяется на сиреневую:
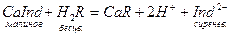
По количеству трилона Б, расходуемого на титрование, определяют содержание Са2+. Титрованием пробы воды трилоном Б в присутствии индикатора хромогена черного определяют суммарное содержание Са2+ и Mg2+ то есть общую жесткость воды. Вода, содержащая Са2+ и Mg2+, в присутствии хромогена черного окрашивается в красный цвет вследствие образования комплекса с Mg2+. При титровании воды в точке эквивалентности происходит изменение цвета на синий вследствие протекания следующей реакции:

Содержание Mg2+ вычисляют по разности между общим содержанием (Са2+ + Mg2+) и содержанием Са2+. Трилонометрическое определение каждого иона производится при том значении рН, при котором этот ион образует с трилоном Б соединение более прочное, чем с индикатором. Для поддержания заданного значения рН к титруемому раствору добавляют буферные растворы. Кроме того, поддержание заданной величины рН обеспечивает определенную окраску индикатора. Общую жесткость воды определяют при рН > 9, кальциевую – при рН = 12.
Определение диоксида углерода производят титрованием пробы воды щелочью в присутствии индикатора–фенолфталеина:
CO2 + 2NaOH = Na2CO3 + H2O
H2S + HgCl2 = HgS↓ + 2HCl
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 516; Нарушение авторских прав?; Мы поможем в написании вашей работы!