
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ОВР и их виды
|
|
|
|
Любая окислительно-восстановительная реакция (ОВР) состоит из двух сопряженных процессов:
1. Окисление – это процесс отдачи электронов частицей, который приводит к повышению С.О. элемента

2. Восстановление – это процесс приема электронов частицей, который сопровождается уменьшением С.О. элемента
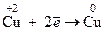
Вещества, отдающие свои электроны в процессе окисления, называются восстановителями, а вещества, принимающие электроны в процессе восстановления, являются окислителями. Если обозначить через Ох окисленную форму вещества, а через Red – восстановленную, то любая ОВР может быть представлена в виде суммы двух процессов:
Red 1 – n ē ® Ox 1 (окисление);
Ox 2 + n ē ® Red 2 (восстановление).
Проявление тех или иных окислительно-восстановительных свойств атомов зависит от многих факторов, важнейшие из которых – положение элемента в периодической системе, его С.О. в веществе, характер свойств, проявляемых другими участниками реакции. По окислительно-восстановительной активности вещества принято делить на три группы:
1. Типичные восстановители – это простые вещества, атомы которых имеют не высокие значения ЭО, например металлы, водород, углерод, а также частицы, в которых имеются атомы в минимальной (низшей) для них степени окисления, например хлор в соединении  .
.
2. Типичные окислители – это простые вещества, атомы которых характеризуются высокой ЭО, например фтор и кислород, а также частицы, в составе которых имеются атомы в высшей (максимальной) С.О., например хром в соединении  .
.
3. Вещества, обладающие окислительно-восстановительной двойственностью свойств – это многие неметаллы, например сера и фосфор, а также вещества, содержащие элементы в промежуточной С.О., например марганец в соединении 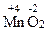 .
.
Реакции, в которых окислители и восстановители представляют собой различные вещества, называются межмолекулярными. Например
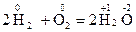
В некоторых реакциях окислителем и восстановителем являются атомы различных по природе элементов одной и той же молекулы, такие ОВР называются внутримолекулярными. Например

Реакции, в ходе которых окислителем и восстановителем является атом одного и того же элемента, находящегося в составе одного и того же вещества, называются реакциями диспропорционирования (иначе самоокисления-самовосстановления или дисмутации). Например
 .
.
Расчет молярных эквивалентных масс М Э окислителя или восстановителя в ОВР следует осуществлять по формуле
М Э = 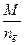 (1)
(1)
где М – молярная масса вещества, г/моль; nē – число электронов, принятых окислителем или отданных восстановителем.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 503; Нарушение авторских прав?; Мы поможем в написании вашей работы!