
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методы уравнивания ОВР
|
|
|
|
Существует несколько способов подбора коэффициентов в уравнениях ОВР, из которых наиболее распространены метод электронного баланса и метод ионно-электронных уравнений (иначе метод полуреакций). Оба метода основаны на реализации двух принципов:
1. Принцип материального баланса – число атомов всех элементов до и после реакции должно быть одинаковым;
2. Принцип электронного баланса – число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем.
Метод электронного баланса является универсальным, то есть им можно пользоваться для уравнивания ОВР, протекающих в любых условиях. Метод полуреакций применим для составления уравнений только таких окислительно-восстановительных процессов, которые протекают в растворах. Однако он имеет ряд преимуществ по сравнению с методом электронного баланса. В частности, при его использовании нет необходимости определять степени окисления элементов, кроме того, учитывается роль среды и реальное состояние частиц в растворе.
Основные этапы составления уравнений реакций по методу электронного баланса состоят в следующем:
1. Записывают схему реакции, определяют С.О. элементов, выявляют окислитель и восстановитель. Например:
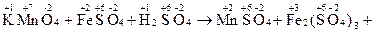 …
…
Очевидно, что С.О. изменяется у марганца (уменьшается) и у железа (увеличивается), таким образом, KMnO4 – окислитель, а FeSO4 – восстановитель.
2. Составляют полуреакции окисления и восстановления
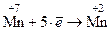 (восстановление)
(восстановление)
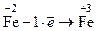 (окисление)
(окисление)
3. Балансируют количество принятых и отданных электронов путем переноса коэффициентов, стоящих перед электронами, в виде множителей, поменяв их местами
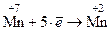 ½´ 1½´ 2
½´ 1½´ 2
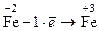 ½´ 5½´ 10
½´ 5½´ 10
Если коэффициенты кратны друг другу, их следует уменьшить, поделив каждый на наибольшее общее кратное. Если коэффициенты нечетные, а формула хотя бы одного вещества содержит четное количество атомов, то коэффициенты следует удвоить.
Так, в рассматриваемом примере коэффициенты перед электронами нечетные (1 и 5), а формула Fe2(SO4)3 содержит два атома железа, поэтому коэффициенты увеличиваем в два раза.
4. Записывают суммарную реакцию электронного баланса, при этом количество принятых и отданных электронов должно быть одинаковым и сократиться на данном этапе уравнивания
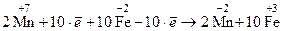
5. Расставляют коэффициенты в молекулярном уравнении реакции и вносят недостающие вещества. При этом коэффициенты перед веществами, которые содержат атомы элементов изменявших С.О., берутся из суммарной реакции электронного баланса, а атомы остальных элементов уравнивают обычным способом, соблюдая следующую последовательность:
- атомы металлов;
- атомы неметаллов (кроме кислорода и водорода);
- атомы водорода;
- атомы кислорода.
Для рассматриваемого примера
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O.
При уравнивании реакций методом ионно-электронных уравнений следует соблюдать следующую последовательность действий:
1. Записывают схему реакции, определяют С.О. элементов, выявляют окислитель и восстановитель. Например:
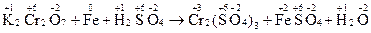
С.О. изменяется у хрома (уменьшается) и у железа (увеличивается), таким образом, K2Сr2O7 – окислитель, а Fe – восстановитель.
2. Записывают ионную схему реакции. При этом сильные электролиты записываются в виде ионов, а слабые электролиты, нерастворимые и малорастворимые вещества, а также газы оставляют в молекулярном виде. Для рассматриваемого процесса
K+ + Cr2O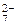 + Fe + H+ + SO
+ Fe + H+ + SO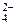 ® Cr3+ + SO
® Cr3+ + SO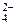 + Fe2+ + H2O
+ Fe2+ + H2O
3. Составляют уравнения ионных полуреакций. Для этого сначала уравнивают количество частиц, содержащих атомы элементов, изменявших свои С.О.
Cr2O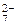 ® 2Cr3+
® 2Cr3+
Fe ® Fe2+
Далее уравнивают кислород и водород, используя частицы, определяющие характер раствора. Возможны три случая:
1) реакция в среде сильных кислот (рН < 7). В этом случае в уравнениях полуреакций рационально применять только ионы Н+ или молекулы Н2О. Если необходимо уменьшить количество атомов кислорода, то его связывают в молекулы воды, а если требуется добавить атом кислорода, то добавляют молекулу воды, при этом освобождается два иона водорода;
2) реакция в среде сильных оснований (рН > 7). Если необходимо отнять у соединения атом кислорода, то добавляют молекулу воды и освобождают два гидроксид иона, а если требуется добавить один атом кислорода, то вносят два иона ОН– и получают одну молекулу воды.
3) реакция в нейтральной среде (рН = 7). В таких реакциях рекомендуется в левую часть полуреакции добавлять только воду. При этом если нужно отдать кислород, то добавляют молекулу воды и получают два гидроксид иона, а если нужно добавить атом кислорода, то добавляют молекулу воды и получают два иона водорода.
Для рассматриваемого примера
Cr2O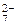 + 14Н+® 2Cr3+ + 7Н2О
+ 14Н+® 2Cr3+ + 7Н2О
Fe ® Fe2+
Затем уравнивают заряды с помощью прибавления или отнятия определенного количества электронов
[Cr2O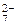 + 14Н+]12+ + 6 ē ® [2Cr3+ + 7Н2О]6+
+ 14Н+]12+ + 6 ē ® [2Cr3+ + 7Н2О]6+
Fe0 – 2 ē ® Fe2+
4. Балансируют количество принятых и отданных электронов так, как это описано в методе электронного баланса
[Cr2O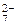 + 14Н+]12+ + 6 ē ® [2Cr3+ + 7Н2О]6+ ½´2½´1
+ 14Н+]12+ + 6 ē ® [2Cr3+ + 7Н2О]6+ ½´2½´1
Fe0 – 2 ē ® Fe2+ ½´6½´3
5. Записывают суммарную реакцию ионно-электронного баланса
Cr2O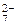 + 14H+ + 6 ē + 3Fe – 6 ē ® 2Cr3+ + 7H2O + 3Fe2+
+ 14H+ + 6 ē + 3Fe – 6 ē ® 2Cr3+ + 7H2O + 3Fe2+
6. Расставляют коэффициенты в молекулярном уравнении реакции
K2Cr2O7 + 3Fe + 7H2SO4 = Cr2(SO4)3 + 3FeSO4 + K2SO4 + 7H2O
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 6319; Нарушение авторских прав?; Мы поможем в написании вашей работы!