
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методы анализа растворов
|
|
|
|
Вопрос №3
Анализ состава жидкостей
Методы анализа состава жидкостей Ведение технологических процессов в химической, газо- и нефтехимической промышленности, энергетике во многих случаях основывается на результатах анализа состава жидкостей. Одним из важных моментов работы по охране окружающей среды является контроль за состоянием естественных и искусственных водоемов, анализ сбросных вод промышленных предприятий и населенных пунктов, которые осуществляются также с использованием анализаторов состава жидкостей. К числу наиболее распространенных методов анализа жидкостей, применяемых в промышленных анализаторах, относятся разновидности электрохимического, оптического и теплового методов, приведенные в табл. 17.1.
В табл. 17.1 не приведены такие методы, как хроматографический, титрометрический, масс-спектрометрический. Первый более широко применяется для анализа состава газа. Титрометрический и масс-спектрометрический методы в основном используются в лабораторной практике и в данной главе не рассматриваются.
Из перечисленных в табл. 17.1 методов наибольшей разрешающей способностью обладают пламенно-ионизационный, колориметрический, амперометрический и кулонометрический, применяемые для измерения микроконцентраций растворенных веществ. Подобно газоанализаторам приборы для анализа жидкостей представляют собой установки, содержащие помимо первичных и измерительных преобразователей вспомогательные устройства для подготовки пробы и ее транспортирования.
Таблица 17.1
| Метод | Измеряемая величина |
| Электрохимический Кондуктометрический Потенциометрический Амперометрический Кулонометрический | Общая электрическая проводимость, концентрация диссоциирующего вещества в растворе, кондуктометрическое титрование Концентрация конкретных ионов (ионометрия), окислительно-восстановительный потенциал (редоксометрия), потенциометрическое титрование Концентрация определенного вещества в растворе или расплаве |
| Оптический Колориметрический Пламенно-фотометрический Турбидиметрический Нефелометрический | Концентрация определенного вещества в растворе или расплаве Концентрация взвешенных частиц в суспензиях и эмульсиях |
| Тепловой Термокондуктометрический | Измерение концентрации растворенных газов |
Кондуктометрический метод анализа растворов. Водные растворы электролитов представляют собой проводники второго рода, перенос тока в которых осуществляется движением ионов. Последние образуются при диссоциации веществ, находящихся в растворе. Электропроводность характеризует суммарную концентрацию находящихся в растворе ионов, в связи с чем приборы для ее измерения градуируются в единицах удельной электропроводности: См/см (Сименс на сантиметр) и мкСм/см, в единицах условного солесодержания (мг/кг NaCl) или концентрации (% H2SО4).
Удельная электропроводность раствора  , См/см, являющаяся величиной, обратной удельному сопротивлению, связана с эквивалентной концентрацией η (r -экв/см3) следующей зависимостью:
, См/см, являющаяся величиной, обратной удельному сопротивлению, связана с эквивалентной концентрацией η (r -экв/см3) следующей зависимостью:
 (17.1)
(17.1)
где  — степень диссоциации молекул растворенного вещества;
— степень диссоциации молекул растворенного вещества;
 — эквивалентная электропроводность вещества при бесконечном разбавлении.
— эквивалентная электропроводность вещества при бесконечном разбавлении.
Степень диссоциации определяется числом молекул, диссоциированных на ионы. При одной и той же концентрации молекулы сильных электролитов диссоциируют больше, чем слабых. К сильным относятся соляная, серная, азотная кислоты, большинство солей, щелочи, к слабым электролитам — органические кислоты. По мере снижения концентрации степень диссоциации растет, приближаясь к единице.
При полной диссоциации молекул эквивалентная электропроводность раствора определяется подвижностью анионов 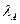 и катионов
и катионов  , зависящей от природы диссоциированного вещества и свойств растворителя, т.е.
, зависящей от природы диссоциированного вещества и свойств растворителя, т.е.  .
.
Поскольку в (17.1)  меняется с изменением концентрации, зависимость удельной электропроводности от концентрации носит сложный характер. Графики этих зависимостей для ряда веществ представлены на рис. 17.1. Как видно из графиков, близкий к линейному рост электропроводности с увеличением концентрации наблюдается при значениях последней, составляющих 5...10 %. Рост концентрации свыше 15...30% сопровождается снижением электропроводности из-за уменьшения степени диссоциации молекул.
меняется с изменением концентрации, зависимость удельной электропроводности от концентрации носит сложный характер. Графики этих зависимостей для ряда веществ представлены на рис. 17.1. Как видно из графиков, близкий к линейному рост электропроводности с увеличением концентрации наблюдается при значениях последней, составляющих 5...10 %. Рост концентрации свыше 15...30% сопровождается снижением электропроводности из-за уменьшения степени диссоциации молекул.
Учитывая неоднозначный характер зависимости электропроводности от концентрации, необходимо заранее знать область работы кондуктометра, исключая возможность измерений в области экстремума.
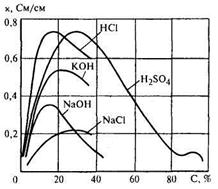
Рис. 17.1. Графики зависимости удельной электропроводности от концентрации при 18 °С
Удельная электропроводность раствора зависит не только от концентрации вещества и его природы, но и от температуры. Уравнение Кольрауша устанавливает связь между удельной электропроводностью раствора и температурой:
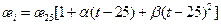 . (17.2)
. (17.2)
При изменении температуры в пределах 15...35 °С квадратичный член в уравнении (17.2) может быть опущен. В табл. 17.2 приведены значения подвижностей ионов при температуре 25 °С и температурный коэффициент а, характеризующий увеличение подвижности ионов с ростом температуры.
Таблица 17.2
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 1666; Нарушение авторских прав?; Мы поможем в написании вашей работы!