
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Контрольные растворы
|
|
|
|

Потенциометрический метод анализа. В практике анализа растворов значительное место занимают потенциометрические анализаторы, предназначенные для избирательного измерения активной концентрации определяемых ионов, в связи с чем их называют иономерами. Потенциометрический метод измерения базируется на законе Нернста, который был открыт для металлических электродов, а позднее распространен на электроды других веществ. Сущность рассматриваемого явления состоит в том, что при погружении металлического электрода в раствор на его поверхности возникает потенциал, зависящий от активной концентрации ионов этого металла в растворе. Возникновение потенциала обусловлено переходом ионов металла в раствор. В состоянии равновесия поверхностный потенциал обеспечивает выравнивание скоростей анодного и катодного процессов, связанных с переходом ионов металла в раствор и из раствора в электрод. Измерение поверхностного потенциала электрода позволяет судить о концентрации соответствующих ионов в растворе.
Уравнение Нернста, устанавливающее связь между равновесным потенциалом Е на поверхности электрода и активной концентрацией соответствующих ионов в растворе а, имеет следующий вид.
Е = Е0 + RT(lna)/(nF), (17.5)
где Е0 — нормальный потенциал;
R — газовая постоянная;
T — абсолютная температура;
п — заряд ионов;
F— число Фарадея.
Для измерения равновесного поверхностного потенциала Е необходимо замкнуть электрическую цепь, вводя в раствор второй электрод, называемый вспомогательным или электродом сравнения. Потенциал этого электрода в процессе измерения должен оставаться постоянным. Для характеристики потенциалобразующих свойств различных веществ значения равновесных потенциалов определяются по отношению к вспомогательному платиновому водородному электроду, принятому в качестве нормального. Этот электрод представляет собой платиновую пластину, погруженную в раствор с активной концентрацией ионов водорода, равной единице, при давлении водородного газа 0,1 МПа и температуре 298 К. Равновесные потенциалы электродов Е0, определенные при их погружении в соответствующие однонормальные растворы по отношению к нормальному водородному электроду, являются измеренными по так называемой водородной шкале и считаются нормальными. Нормальные потенциалы для некоторых видов веществ приведены в табл. 17.4.
Таблица 17.4
Нормальные электродные потенциалы, определенные по водородной шкале
| Электрод | Потенциал, В | Электрод | Потенциал, В |
| Li+/Li | -3,045 | Cu2+/Cu | +0,337 |
| К+/К | -2,925 | Ag+/Ag | +0,799 |
| Са2+/Са | -2,866 | Hg2+/Hg | +0,845 |
| Na+/Na | -2,714 | Pt2+/Pt | +0,910 |
| А13+/А1 | -1,662 | Cr7Cl2, Pt | + 1,3595 |
| Fe2+/Fe | -0,4402 | Au3+/Au | + 1,498 |
В табл. 17.4 знак минус стоит у потенциалов веществ, которые в ряду активностей стоят перед водородом. В графе «электрод» указаны потенциалобразующие ионы и за чертой — материал рабочего электрода.
В настоящее время область применения потенциометрических методов измерения расширяется благодаря созданию ионоселективных электродов, обладающих специфическими функциями по отношению к таким катионам и анионам, как Na+, К+, Са2+, Pb2+, С1-, Вг-, 1- и др. Этот метод используется также для измерения окислительно-восстановительного потенциала, характеризующего отношение активностей окисленной и восстановленной форм ионов в растворе. Вспомогательный электрод в этом случае является нейтральным, а на рабочем электроде развивается потенциал, при котором устанавливается динамическое равновесие между скоростями перехода электронов от восстановленной формы ионов к электроду и от электрода к окисленной форме ионов:
Е = E0 + 0,058[lga0x/aRd]/n, (17.6)
где а0х, aRd — активности окисленной и восстановленной форм ионов;
п — число электронов, участвующих в реакции;
Е0 — нормальный окислительно-восстановительный потенциал системы при а 0 х / аRd
Приборы, предназначенные для измерения окислительно-восстановительного потенциала, называются редоксметрическими анализаторами.
Активная концентрация ионов в растворах обычно выражается в единицах десятичного логарифма. Так,
рН = -lg а Н+, pNa = -lg аNa+,
в связи с этим измерительные приборы получили соответственно название рН-метров, pNa-метров и т.д. Наиболее широко потенциометрические приборы применяются для измерения активной концентрации ионов водорода. Их использование осуществляется в двух направлениях, связанных с измерением щелочных или кислотных функций раствора и определением момента нейтрализации растворов при их титровании.
Чистая вода представляет собой нейтральное вещество, слабо диссоциирующее с образованием ионов водорода Н+ и гидроксила ОН-. При температуре 22 °С константа диссоциации воды определяется выражением
KH20 = а н+· a QH- = 10-14,
откуда
a H+ = а ОH = 10-7, рН = 7.
При растворении в воде кислот повышается концентрация ионов водорода, рН снижается. При растворении щелочи концентрация ионов водорода снижается, а рН растет. Таким образом, отклонение числа рН в водных растворах от 7 в ту или другую сторону характеризует меру их кислотных или щелочных свойств. Если температура чистой воды повышается до 100 °С, то она приобретает кислые свойства, при этом число рН снижается до 6,12. Вода с нулевой температурой обладает щелочными свойствами и рН = 7,97. Для водных растворов диапазон изменения рН составляет 0...14, для аммиачных рН = 0...32,7, а для муравьиной кислоты рН = 0...6,13.
Рабочие и вспомогательные электроды потенциометрических анализаторов. Для получения поверхностного скачка потенциала, зависящего от активной концентрации соответствующих ионов в растворе, могут использоваться электроды трех типов. Электроды первого типа представляют собой металлы, либо металлы с сорбированным на поверхности газом, например, как водородный электрод. Электроды второго типа являются системами, включающими в себя металлический контактный электрод, его плохо растворимую соль и раствор, содержащий анионы этой соли, определяющие потенциал электрода, например Ag/AgCl/HCl. К третьему типу относятся электроды специального назначения, такие, например, как электроды с жидкостными мембранами. Электроды из чистых металлов в растворах быстро покрываются слоем окисной пленки и других химических соединений, что приводит к изменению характеристик электрода и потере специфических функций.
В качестве образцового электрода для измерения числа рН растворов используются водородные электроды (рис. 17.8). Электрод представляет собой платиновую пластинку, покрытую слоем платиновой черни, на поверхности которой хорошо сорбируется водород. Платиновая пластинка погружается в раствор, через который пропускается под давлением водород. При образовании первичного преобразователя (электродной системы, сенсора), из двух водородных электродов, из которых вспомогательный является нормальным, при температуре 20 °С развивается Е = 0,058рН, В. На границе раздела анализируемого раствора и раствора нормального электрода возникает диффузионный потенциал, вызывающий ошибку в измерении рН, достигающую 0,05 рН. Необходимость подачи в электрод водорода, отравление платины рядом химических веществ, присутствующими в растворах, обусловили их использование только в качестве образцовых, применяемых в лабораторной практике.
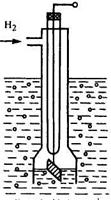
Рис. 17.8. Схема водородного электрода
Для измерения числа рН в лабораторных и промышленных условиях используются стеклянные рабочие электроды, широкому распространению которых способствовала простота их устройства, высокие метрологические характеристики и широкий диапазон анализируемых сред. В стеклянных электродах водородными функциями обладает чувствительная тонкостенная мембрана, выполненная из литиевого или натриевого стекла. Согласно одной из наиболее распространенных теорий водородные функции мембраны обусловлены замещением ионов щелочных металлов, находящихся внутри силикатной решетки стекла, более подвижными ионами водорода. Замещение происходит до наступления равновесного состояния. Мембраны из литиевого стекла получили большее распространение вследствие их меньшей восприимчивости к катионам щелочных металлов в растворе, обладающих по сравнению с литием большими размерами ионов.
Принципиальная схема рабочего стеклянного электрода и его эквивалентная электрическая схема представлены на рис. 17.9. Электрод выполнен из толстостенной стеклянной калиброванной трубки 1, к концу которой припаяна чувствительная мембрана из литиевого стекла 2. На внешней поверхности мембраны при погружении ее в раствор развивается потенциал Е3, зависящий от активной концентрации ионов водорода. Стеклянный электрод заполнен раствором кислоты постоянной концентрации 3, который замыкает электрическую цепь между мембраной и контактным электродом 4, соединенным с выводным проводником 5. Для обеспечения постоянства потенциала Е1 возникающего на поверхности контактного электрода 4, используется второй тип электрода, включающего металл Ag, его плохо растворимую соль AgCl и раствор, содержащий анионы соли НС1. Поскольку концентрация раствора внутри стеклянного электрода постоянна, потенциал Е1, согласно (17.5) зависит только от температуры раствора.
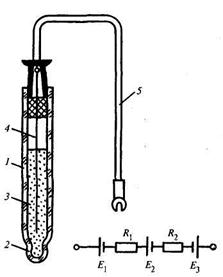
Рис. 17.9. Схема рабочего стеклянного электрода:
1 — калиброванная трубка; 2 — мембрана из литиевого стекла; 3 — постоянная концентрация раствора;
4 — контактный электрод; 5 — выводной проводник
На внутренней поверхности чувствительной мембраны 2 развивается потенциал Е2, который при постоянной концентрации раствора 3, так же как и Е1, зависит только от температуры. Чувствительная мембрана обладает асимметрией, которая проявляется в виде разности потенциалов на внешней и внутренней поверхностях при одинаковых активных концентрациях ионов водорода в растворах внутри и вне электрода.
Эквивалентная электрическая схема помимо рассмотренных Е2, Е3 включает активные сопротивления R1, и R2. Сопротивление R1, соответствует сопротивлению раствора электролита внутри электрода, a R2 — сопротивлению чувствительной мембраны. Первое сопротивление ничтожно мало по сравнению с сопротивлением мембраны, достигающим 109 Ом. Это сопротивление зависит от температуры и снижается приблизительно в 2 раза при изменении температуры на каждые пять градусов.
В измерительной практике используются хлорсеребряные, бром-серебряные и каломельные стеклянные электроды. В первых двух электродах в качестве контактного используется серебряный электрод, покрытый слоем плохо растворимой соли хлористого или бромистого серебра AgCl, AgBr, при этом электроды заполнены соответственно растворами НС1 или НВг. Внутри рабочего стеклянного каломельного электрода находятся ртуть, ее плохо растворимая соль Hg2Cl2 (каломель) и раствор КС1. Контактный электрод вводится внутрь ртути. Использование в каломельном электроде токсичной ртути ограничивает область его применения.
Крутизна водородной характеристики промышленных стеклянных электродов определяется уравнением (ГОСТ 16287-77) St = -(54,197 + 0,19840,мВ/(рН °С). При температуре 20 °С чувствительность составляет 58 мВ/рН, температурный коэффициент равен примерно 0,2 мВ/(рН °С). Промышленные стеклянные электроды выпускаются в нескольких модификациях, отличающихся диапазоном измерения рН, областью температур и давлений анализируемой среды, верхние их значения составляют по температуре 150 °С, подавлению 1,2 МПа. Для того, чтобы стеклянный электрод полностью приобрел водородные функции, его перед включением вымачивают в дистиллированной воде.
Для замыкания электрической цепи в раствор помимо рабочего электрода вводится вспомогательный электрод (сравнения). В качестве вспомогательных электродов используют электроды второго типа — хлорсеребряные, реже — каломельные. Для исключения влияния температуры анализируемого раствора на ЭДС вспомогательных электродов последние часто делают выносными с замыканием электрической цепи через электролитический ключ. Схема хлорсеребряного выносного вспомогательного электрода представлена на рис. 17.10. Контактный серебряный электрод 1 помещен в пластмассовый корпус 2, в нижней части которого находится электрический вывод 3. Электрод показан с навинченной крышкой 4 и пробкой 5, которые используются при транспортировке и хранении электрода. При работе электрода они снимаются и электрод ввинчивается в дно резервуара с насыщенным раствором КС1.
Серебряный электрод 1 окружен кристаллами хлористого серебра 6, которые для предотвращения диффузии отделены от насыщенного раствора КС1 7 пористой перегородкой 8. Вспомогательный электрод рассмотренной конструкции работает в цепях с переносом, работа которых сопровождается переходом электролита из одного раствора в другой.
В электродной системе, представленной на рис. 17.11, вспомогательный электрод 1 находится в резервуаре 2, заполненном насыщенным раствором КС1. Электрическая цепь между стеклянным электродом 3, погруженным в анализируемый раствор 4, и вспомогательным электродом 1 замыкается через раствор КС 1, стекающий по резиновой трубке 5 в анализируемый раствор. На конце трубки 5 находится винт 6 с микропористой прокладкой, с помощью которых устанавливается медленный сток раствора, достигающий 15...30 мл/сут.
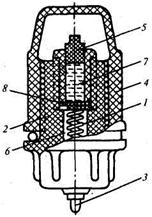
Рис. 17.10. Схема выносного вспомогательного электрода:
1 — серебряный электрод; 2 — пластмассовый корпус; 3 — электрический вывод; 4 — крышка; 5 — пробка; 6— кристаллы хлористого серебра; 7 — насыщенный раствор КС I; 8 — пористая перегородка
Трубка 5 с протоком раствора электролита называется «соляным мостиком» или «электролитическим ключом». Вытекание раствора КС1 исключает возможность проникновения посторонних ионов во вспомогательный электрод. Поскольку ионы К+ и С1~ обладают близкими подвижностями, диффузионный потенциал, возникающий на границе двух растворов, незначителен. Выпускаемые модификации выносных электродов могут работать при давлении анализируемой среды до 0,6 МПа.
Эквивалентная электрическая схема электродной системы кроме рассмотренных Е1 —Е3, R1, R2 содержит ЭДС вспомогательного электрода, диффузионную разность потенциалов, суммарное сопротивление вспомогательного электрода и анализируемого раствора. Сопротивление вспомогательного электрода с электролитическим ключом составляет 2...5 кОм. Вспомогательные электроды могут выполняться непроточными.
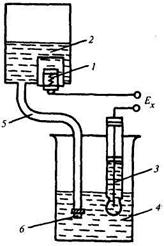
Рис. 17.11. Схема электродной системы рН-метра с выносным вспомогательным эдектродом:
1 — вспомогательный электрод; 2 — резервуар; 3 — стеклянный электрод; 4 — анализируемый раствор;
5 — резиновая трубка; б — винт с микропористой прокладкой
Для лабораторных измерений выпускаются вспомогательные электроды различных конструкций, схема одной из которых представлена на рис. 17.12, а. Корпус 1 электрода выполнен из стекла, в насыщенный раствор КС1 опущена стеклянная трубка 2, закрытая снизу асбестовой проницаемой пробкой. Внутри трубки 2 находится контактный серебряный электрод 3, окруженный раствором КС1 и кристаллами хлористого серебра. Электрическая связь контактного электрода с анализируемым раствором осуществляется с помощью электролитического ключа, роль которого играет пропитанный раствором шнур 4. Через отверстие 5 в корпусе электрода может доливаться раствор КС1.
В настоящее время выпускаются разнообразные конструкции электродов. Рабочие и вспомогательные электроды могут выполняться в пластмассовом корпусе. В комбинированных электродах рабочий и вспомогательный электроды объединены в одном корпусе, который может быть стеклянным или пластмассовым. Использование комбинированных электродов упрощает выполнение экспрессного и лабораторного анализа. К числу перечисленных относятся электроды, предназначенные для измерения рН и окислительно-восстановительного потенциала серии 871 (ф. Foxboro), мод. 7777/7794 (ф. Honeywell), 2G, 2М (ф. Jumo) и др. На рис. 17.12, б представлена схема стеклянного комбинированного электрода типа ЭСК-1. Чувствительная мембрана 1 контактирует с анализируемым раствором. Внутри ее в растворе НС1 с кристаллами AgCl находится контактный серебряный электрод 2. Внутри толстостенного корпуса 3 находится раствор КС1 и хлорсеребряный электрод сравнения 4. Последний с раствором КС1 сообщается через проницаемую пробку 5. Цепь электродов рабочего и сравнения замыкается через проницаемую пробку 6. Электрическое сопротивление такого комбинированного электрода находится в пределах 10...450МОм.
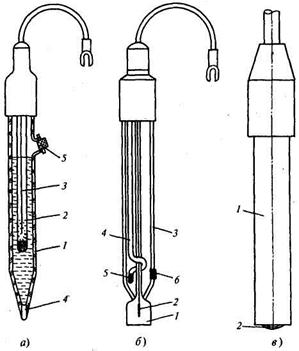
Рис. 17.12. Схемы электродов рН-метров:
а — вспомогательный стеклянный электрод: 1 — корпус; 2 — стеклянная трубка; 3 — серебряный электрод; 4 — шнур; 5 — отверстие; б — стеклянный комбинированный электрод типа ЭСК-1: 1 — чувствительная мембрана; 2 — контактный серебряный электрод; 3 — корпус; 4 — хлорсеребряный электрод сравнения;
5, 6 — проницаемые пробки; в — ионоселективный рабочий электрод: 1 — пластмассовый корпус;
2 — чувствительная мембрана
Для измерения таких ионов как Cl-, Br-, I-, Na+, K+, NH+4 используются ионоселективные электроды. В портативном микропроцессорном рН-метре-иономере «Экотест-120» число контролируемых ионов достигает 27- Схема ионоселективного рабочего электрода представлена на рис. 17.12, в. Чувствительная мембрана 2 находится в нижней части пластмассового корпуса 1.В зависимости от анализируемых ионов она может быть керамической, моно- или поликристаллической. Эти электроды работают в паре с хлорсеребряными электродами сравнения.
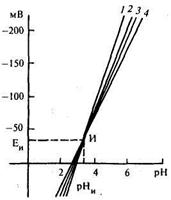
Рис. 17.13. Градуировочная характеристика электродной системы:
l — 4 — tº = 100 °С;60; 20; 0
Общий вид градуировочной характеристики электродной системы рН-метра представлен на рис.17.13. Результирующая ЭДС, развиваемая электродной системой, зависит от числа рН раствора и его температуры. В точке И от температуры ЭДС не зависит, в связи с чем она называется изопотенциальной. В этой точке влияние температуры раствора на внешний Е3 и внутренние Е1, Е2 потенциалы стеклянного электрода взаимно скомпенсировано. Уравнение, описывающее рассмотренные характеристики, имеет вид Е = Еи + [S20 + α(t - 20)](рН - рНи), где S20, α — крутизна характеристики электродной системы при температуре 20 °С и ее температурный коэффициент.
Выпускаемые отечественной промышленностью рабочие стеклянные и вспомогательные электроды стандартизованы. Для одной из промышленных электродных систем, включающей стеклянный рабочий электрод и выносной вспомогательный насыщенный хлор-серебряный электрод, градуировочная характеристика определяется выражением Е = -33 - (54,197 + 0,1984tр)(рН - 3,28). Для этой системы координаты изопотенциальной точки составляют Еи = -33 мВ, рНи = 3,28. У других электродных систем координаты изопотенциальной точки различаются, в связи с чем выбор электродных систем должен производиться исходя из диапазона измеряемых значений рН.
В промышленных рН-метрах электродная система снабжается дополнительной арматурой, обеспечивающей размещение электродов на технологических объектах, их контакт с измеряемой средой и защиту электродов от механических воздействий. Как и первичные преобразователи кондуктометров, электродные системы рН-метров выпускаются следующих типов: магистральные ДМ, погружные ДПг и проточные ДПр. Первые помещаются в трубопровод, по которому протекает анализируемая среда, вторые опускаются в резервуар, а через последние протекает анализируемый раствор из отбора, пройдя устройство подготовки пробы. Схема установки рН-метра с погружным первичным преобразователем (датчиком) ДПг представлена на рис. 17.14. Преобразователь 1 установлен на крышке резервуара. В анализируемый раствор погружены стеклянный электрод 2 и фторопластовая трубка 3, по которой раствор КС1 стекает из бачка 4. В последнем находится вспомогательный выносной электрод. В анализируемый раствор погружен также медный термопреобразователь сопротивления 5.
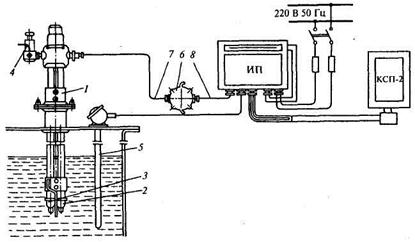
Рис. 17.14. Схема установки рН-метра с погружным электродным преобразователем:
1 — преобразователь; 2 — электрод; 3 — фторопластовая трубка; 4 — бачок; 5 — медный термопреобразователь сопротивления; 6 — распределительная коробка; 7 — кабель электродов;
8 — высокоточный радиотехнический кабель
Для подключения электродной системы к измерительному преобразователю ИП используется распределительная коробка 6, в которой с помощью специального разъема кабель электродов 7 соединяется с высокочастотным радиотехническим кабелем 8, идущим к измерительному преобразователю ИП. Глубина погружения электродов достигает 2 м, расстояние между первичным и измерительным преобразователями не превышает 150 м.
Измерительные преобразователи рН-метров. Устройство приборов, предназначенных для измерения ЭДС электродной системы, определяется ее значительным внутренним сопротивлением и ограничением по величине протекающего через электроды тока, который для исключения поляризации электродов не должен превышать 10-12 А. Учитывая это требование, измерительные приборы должны иметь входное сопротивление не менее 1012 Ом.
Измерительные схемы различных преобразователей рН-метров имеют общие характерные черты, обусловленные видом градуировочных характеристик и их возможными отклонениями. Элементы измерительной схемы должны обеспечивать возможность введения ручной или автоматической температурной компенсации, допускать коррекцию параметров изопотенциальной точки рНи, Еи и крутизны градуировочной характеристики. В изопотенциальной точке температурная компенсация должна отсутствовать. Общие приемы решения этих задач рассмотрим на примере схемы измерительного блока
аналогового преобразователя рН-011 (НПП «Техноприбор»), представленной на рис. 17.15.
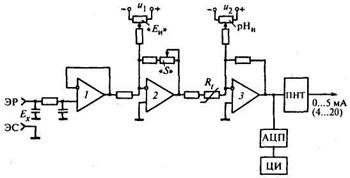
Рис. 17.15. Упрощенная схема аналогового преобразователя рН-метра
Сигнал от электродной системы Ех подается на вход, повторителя 1, имеющего высокоомный вход. За счет изменения коэффициента усиления микросхемы 2 корректируются отклонения крутизны электродной системы «S» от номинального значения. В этом же каскаде сигналом от источника и, компенсируется координата изопотенциальной точки «Еи». В следующем каскаде вводятся компенсации как влияния температуры с помощью медного резистора Rt, находящегося в анализируемом растворе, так и координаты изопотенциальной точки «рНи». За счет этих сигналов исключается введение сигнала температурной компенсации в изопотенциальной точке. Признаком правильной настройки измерительного блока является отсутствие изменений выходного сигнала при изменении сопротивления R, в точке рН = рНи (Ех = Eи)
Выходной сигнал после каскада 3 поступает на аналого-цифровой преобразователь АЦП с цифровым 4-разрядным индикатором ЦИ и на преобразователь напряжения в ток ПНТ, обеспечивающего получение унифицированных токовых сигналов 0...5 и 4...20 мА. ПНТ имеет несколько каскадов, включающих гальваническое разделение, переключатели изменения диапазонов измерения, резисторы плавной регулировки. Прибор имеет при переменном нижнем пределе измерения диапазоны от 1 до 15рН и -2000...2000 мВ. Погрешность измерительного блока составляет ±0,05 рН и ±2 мВ.
В микропроцессорных рН-метрах упрощается процесс настройки, поскольку градуировочные характеристики конкретной электродной системы вводятся в постоянную память микропроцессора. Используя сигналы электродной системы и термопреобразователя микропроцессор рассчитывает значение рН.
К числу наиболее распространенных в стране рН-метров относятся рН-201 и рН-261. Их измерительные преобразователи имеют выходные сигналы по постоянному напряжению 0...50 мВ и токовый 0...5 мА. Это обеспечивает возможность их работы в комплекте с автоматическими потенциометрами, устройствами регулирования и контроля, использующими унифицированный токовый сигнал. Прибор рН-201 имеет пять диапазонов измерения числа рН: 1; 2,5; 5; 10; 15, предельная допустимая погрешность составляет ±1 % диапазона измерения.
Микропроцессорные рН-метры выпускаются многими зарубежными фирмами, такие анализаторы входят в состав серии SIPAN (ф. Siemens), приборы серии 8701Т, 873, 875 (ф. Foxboro), мод. 97826 7096 (ф. Honeywell), PHI50, РН202 (ф. Yokogawa), dTRANS рН 01 (ф. Jumo) и др.
При выпуске и эксплуатации рН-метров производится как раздельная поверка электродов и измерительных преобразователей, так и комплектов рН-метров в целом. Для воспроизведения шкалы рН водных растворов в диапазоне температур от 0 до 150 °С используются буферные растворы, представляющие собой растворы хорошо диссоциирующих солей слабых кислот и сохраняющих постоянство рН при разбавлении растворов водой и добавлении небольших количеств свободной кислоты пли щелочи. В табл. 17.5 для температуры 25 °С приведены рН буферных растворов.
Поверка промышленных стеклянных электродов производится по буферным растворам в комплекте с образцовым электродом сравнения.
Для проверки измерительного преобразователя и его настройки используются высокоомные потенциометры и имитаторы электродной системы.
Рассмотренные измерительные преобразователи могут работать в комплекте с мембранными электродами ЭМ, селективными к ионам Mg2+, Са2+, К+, CI-, Вr- I-, CN-, ОН-. Ионоселективными функциями по отношению к Na+ обладают электроды из натриевого стекла, для подавления их водородной функции в анализируемый раствор вводится буферный аммиачный раствор, стабилизирующий рН. Определитель натрия АН-012 имеет диапазоны измерения от 0,1... 10 мкг/л до 1...1000 мг/л, предел приведенной погрешности составляет +2%. Для измерения pNa фирма Honeywell выпускает анализаторы моделей 7972, 7082.
Хлоридомер АХП-205 имеет пределы измерения 1,5—3,5 рС1, dTRANS Fz 01 (ф. Jumo) поставляется с электродами для измерения свободного хлора, диоксида хлора и озона.
Таблица 17.5
| Буферный раствор | рH | Буферный раствор | pН |
| 0,1 m раствор НС1 | 1,10 | 0,008695 m раствор однозамещенного фосфорнокислого калия (КН2Р04) и 0,03043 m двух-замещенного фосфорнокислого натрия (Na2HP04) | 7,41 |
| 0,05 m раствор тетраоксалата калия (КН3(С204)2, 2Н,0) | 1,68 | ||
| Насыщенный при 25 °С раствор виннокислого кислого калия С2Н402(СООК)(СООН) | 3,56 | ||
| 0,05 m раствор фталевокислого кислого калия С6Н402(СООК)(СООН) | 4,01 | 0,01 m раствор тстраборнокис-лого натрия (Na,B407, 10Н2О) | 9,18 |
| Раствор, содержащий 0,025 m форфорнокислого однозамещенного калия (КН2Р04) и 0,025т фосфорнокислого двухзамещенного натрия (Na2HP04) | 6,86 | Насыщенный при 25 °С раствор гидрата оксида кальция Са(ОН)2 | 12,45 |
Для измерения окислительно-восстановительного потенциала (ORP) раствора применяются инертные металлические электроды, на поверхности которых не протекают электродные реакции, а осуществляется лишь контакт с раствором. В отечественных Eh -метрах в качестве рабочего электрода используется тонкослойный платиновый электрод, а в качестве электрода сравнения — хлорсеребряный. Поскольку при одинаковых окислительно-восстановительных свойствах Eh зависит от рН раствора, то обычно измерение первого показателя ведется параллельно с измерением второго.
Лабораторные потенциометрические преобразователи, называемые иономерами, являются универсальными приборами, снабжаемые комплектом ионоселективных электродов, позволяющих производить измерение концентрации перечисленных выше ионов. К числу таких приборов относятся иономеры: универсальный лабораторный В-741, лабораторные И-115, И-120, И-130 и переносные рН-125, П-210, П-215.
Оптический метод анализа состава жидкостей. В оптических анализаторах жидкостей используется связь между параметрами оптического излучения и составом анализируемой жидкости. Для анализа состава жидкостей чаще используются следующие разновидности оптического метода: колориметрический, пламенно-фотометрический, турбидиметрический и нефелометрический.
Колориметрические анализаторы. В колориметрических анализаторах концентрация определяемого вещества измеряется по поглощению излучения в видимой части спектра анализируемым раствором. Поскольку для измерения излучения используются различные виды фотоэффекта, анализаторы называются фотоколориметрическими или фотоколориметрами.
В большинстве случаев фотометрируемый окрашенный раствор получается в результате вспомогательной химической реакции, которая обеспечивает избирательное изменение окраски раствора и ее интенсивности в зависимости от концентрации определяемого компонента, при этом в растворе не должно образовываться взвешенных частиц.
В оптический канал между источником излучения и фотоэлементом окрашенный раствор вводится кюветой, выполненной из стекла и обладающей пренебрежимо малыми потерями светового потока из-за поглощения и отражения. Для истинных растворов ослабление излучения на выходе кюветы определяется законом Ламберта—Бера (см. § 16.5).
Оптическая плотность раствора Dλ, как и газа, зависит от коэффициента спектрального поглощения ελ, длины кюветы L и концентрации измеряемого компонента с, определяющей интенсивность окраски раствора:
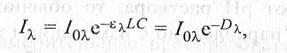
(17.7)
где I λ, I 0λ — интенсивность монохроматического излучения на выходе и входе кюветы.
Если длина кюветы выражается в сантиметрах, а концентрация в г-моль/л, то коэффициент ελ в (17.7) называется молярным коэффициентом поглощения. Чем выше ελ, тем меньшие концентрации компонентов могут быть измерены этим методом. В идеальном случае ελ не зависит от концентрации определяемого компонента, т.е. оптическая плотность Dx линейно растет с увеличением концентрации. Однако в реальных условиях в результате химических реакций между окрашенными частицами и молекулами растворителя наблюдаются отклонения от закона Ламберта—Бера, чаще в сторону снижения молярного коэффициента поглощения. Эти отклонения обусловили необходимость экспериментального определения градуировочной характеристики, связывающей оптическую плотность раствора с концентрацией определяемого компонента.
В качестве лучеприемников в фотоколориметрах используются фоторезисторы, фотоэлементы с внешним и внутренним фотоэффектом, фотоумножители. Их подбирают так, чтобы максимум спектральной характеристики лучеприемника совпадал с экстремумом коэффициента спектрального поглощения анализируемого раствора или был близок к нему.
При проведении колориметрического анализа различают чувствительность фотометрической реакции и чувствительность метода в целом. Первая зависит от выбора реактива и условий реакции, вторая определяется средствами и способом измерения оптической плотности, условиями приготовления реактивов, наличием мешающих примесей. Полнота перевода определяемого вещества в окрашенный комплекс зависит от рН раствора, поэтому его контроль часто осуществляется при приготовлении рабочего раствора. В выпускаемых в настоящее время отечественных и зарубежных фотоколориметрах используются различные варианты одно- и двухканальных оптических систем.
Автоматические фотоколориметрические приборы являются сложными устройствами периодического действия. Они содержат значительное число электрических клапанов, микронасосы, включаемые по команде программного управляющего устройства. Однако благодаря высокой разрешающей способности и универсальности они получают все более широкое распространение для избирательного измерения микроконцентраций различных веществ, находящихся в растворах.
К числу фотоколориметрических приборов относятся автоматические кремнемеры, жесткомеры, фосфатомеры, измерители растворенного в воде кислорода, хлора и др.
Схема автоматического кремнемера ИКА111, выпускаемого НПП «Техноприбор» и предназначенного для измерения концентрации ионов SiO2-, представлена на рис. 17.16. Эти приборы используются на тепловых и атомных электрических станциях при контроле качества химически обессоленной воды. Кремнемер содержит три блока: гидравлический 1, фотометрический с двухканальной оптической системой 2 и не показанный на схеме микропроцессорный блок (МБ) обработки сигналов и управления.
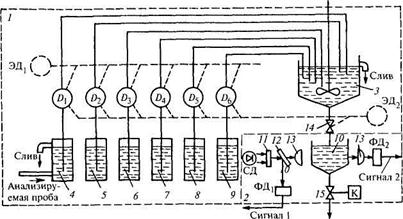
Рис. 17.16. Схема автоматического кремнемера:
1,2 — гидравлический и фотометрический с двухканальной оптической системой блоки; 3 — смеситель;
4 — сосуд постоянного уровня; 5, 6 — сосуды с чистой водой и калибровочным раствором; 7 ÷ 9 — сосуды с молибдатом аммония, серной кислотой и восстановителем; 10 — измерительная кювета;
11 — светофильтр; 12 — светоделительная пластина; 13 —- линзы; 14 — клапан; 15 — электрический клапан; ФД1, ФД2 — фотодиоды; СД — светодиод; Д1 — Д6 — перистальтические насосы;
ЭД1 — ЭД2 — электрические двигатели
Кремнемер представляет собой прибор периодического действия, в котором два раза в час производятся измерения кремнесодержания анализируемого раствора и раз в четыре часа проводится операция контроля начальной и конечной точек диапазона измерения. Для выполнения этой операции используется чистая вода и калибровочный раствор, находящиеся соответственно в сосудах 5, 6. Анализируемая вода поступает из сосуда постоянного уровня 4. В сосудах 7—9 находятся молибдат аммония, серная кислота и восстановитель. Из всех сосудов растворы подаются в смеситель 3 перистальтическими насосами Д1—Д6. В смесителе 3 при перемешивании молибдата аммония с серной кислотой образуется реагент, меняющий свою окраску и ее интенсивность в присутствии ионов SiO2-и восстановителя. Наличие мешалки в смесителе 3 обеспечивает однородность раствора и ускоряет реакцию, для завершения которой требуется 25—30 минут.
Для управления перистальтическими насосами и клапаном 14 используются два электродвигателя: ЭД1, производит вращение насосов, а ЭД2 управляет последовательностью их подключения. Обоими двигателями управляет МБ.
Оптическая система прибора 2 включает измерительную кювету 10, источник света — светодиод СД, светофильтр 77, светоделительную пластину 12, линзы 13, светоприемники-фотодиоды ФД1, ФД2, формирующие опорный 1 и измерительный 2 сигналы. С помощью опорного сигнала компенсируется влияние нестабильности источника светового сигнала. Электрический клапан 75 производит периодический слив раствора из кюветы 10. Сигналы 7, 2 поступают в микропроцессорный блок. Элементы оптического и гидравлического каналов термостатированы.
При корректировки начальной точки диапазона измерения в смеситель 3 сливается молибдат аммония и серная кислота, они тщательно перемешиваются в течение нескольких минут, после чего к ним добавляется доза чистой воды, а затем восстановитель. После перемешивания раствор сливается в измерительную кювету 10. При коррекции конечной точки диапазона измерения выполняется та же последовательность операций, только используется калибровочный раствор. Благодаря проведению этих операций корректируется влияние загрязненности измерительной кюветы и изменения характеристик оптической системы и источника света. Отличие операции измерения от рассмотренных состоит только в использовании анализируемого раствора. Диапазоны измерения кремнемера составляют 2...1000 и 10...10000 мкг/л, относительная погрешность ±1 % при среднем квадратическом отклонении серии параллельных измерений 0,3 %. Фотоколориметрические кремнемеры типа COPRA SILICA выпускает ф. SWAN.
К числу фотоколориметрических приборов относится жесткомер СОЖ-121, предназначенный для измерения микроконцентраций ионов кальция и магния. В качестве вспомогательной реакции используется реакция между ионами Са2+ и Mg2+ с хромом темно-синим в присутствии боратного буферного раствора. В результате реакции проба приобретает красную окраску. Поскольку используемые в приборе реактивы характеризуются высокой чистотой, отсутствует необходимость введения коррекции на колебания оптической плотности реагента. В жесткомере используется двухканальная оптическая система, в качестве лучеприемников применяются фотодиоды. Диапазон измерения жесткомера составляет 2...100 мкг-экв/кг. На рассмотренном принципе действия работают фосфатомеры ИФА 112 и COPRA фирмы SWAN.
К числу наиболее чувствительных анализаторов жидкостей относятся пламенно-фотометрические приборы. Их принцип действия основан на способности возбужденных атомов излучать в определенной части спектра. Поскольку спектр излучения зависит от строения атомов или молекул, метод обладает высокой специфичностью и чувствительностью.
Количественная связь между интенсивностью спектральных линий I э и концентрацией вещества с определяется уравнением Ломакина—Шейбе
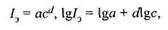
где a, d — коэффициенты, зависящие от характеристик источника света и исследуемого вещества.
Градуировочная характеристика определяется экспериментально по стандартным растворам, близким по составу к анализируемым. Воспроизводимость градуировочной характеристики зависит от тщательности соблюдения условий измерения.
Для возбуждения атомов и молекул могут использоваться дуга, искровой разряд, пламя. Атомы щелочных металлов имеют низкий потенциал возбуждения, поэтому при их анализе применяют пламя, что обеспечивает также простоту анализируемого спектра. В пламенной фотометрии используются различные газы: ацетилен, водород, пропан, бутан.
Чувствительность метода в значительной степени зависит от температуры пламени, определяющей степень возбуждения атомов. В качестве измерительных элементов используются фотоумножители, фотодиоды. Этот метод обладает большой чувствительностью по отношению к атомам щелочных металлов, превышающей чувствительность других химических методов.
Турбидиметрические и нефелометрические анализаторы. Принцип действия турбидиметрических* и нефелометрических приборов основан на измерении ослабленного или рассеянного излучения взвешенными частицами, находящимися в жидкости. Приборы градуируются в единицах либо оптической плотности D, либо коэффициента пропускания τ, %. Если Ф0 исходный световой поток, а Ф — световой поток, прошедший через анализируемый раствор, то
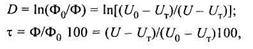
где U0, U— электрические сигналы, пропорциональные Ф0, Ф;
UТ — сигнал при неосвещенном приемнике излучения.
*) От слова turbid (англ.) — мутный.
При прохождении светового потока Ф0 через раствор, содержащий взвешенные частицы, поток ослабляется за счет поглощения его раствором и частицами. Если пренебречь поглощением потока растворителем, то между световым потоком Ф0 на входе анализируемого раствора и потоком Ф на его выходе существует следующее соотношение:
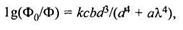
где с, d — концентрация взвешенных частиц и их диаметр;
k, a — постоянные, зависящие от характера суспензии и способа измерения;
b — длина поглощающего слоя;
λ — длина волны.
При фиксированных условиях измерения, виде раствора и взвеси k, d, а, λ являются постоянными и lg(Ф0/Ф) принимает вид закона Ламберта—Бера.
Градуировка турбидиметров производится по стандартным растворам, содержащим известную концентрацию взвешенных частиц, имеющих размеры и природу, близкие к анализируемым. На результаты измерения большое влияние оказывает присутствие посторонних электролитов и неэлектролитов, коллоидов, стабильность дисперсности частиц. В связи с этим метод не обеспечивает высокой точности измерения.
Турбидиметрические анализаторы используются для измерения мутности питьевой и сбросных вод, уровней шлама в отстойниках и технологических аппаратах, концентрации частиц в суспензиях. При измерении концентрации взвешенных частиц в технологических аппаратах и линиях световой поток пропускается непосредственно через слой анализируемой жидкости внутри технологического оборудования. К числу таких приборов относится сигнализаторы уровня осадков СУ-102, СУФ-210 и уровня шлама СУФ-5, используемый при водоочистке в аппаратах, называемых осветлителями, в которых производится предварительная очистка воды. В процессе очистки образуется выводимый из аппарата шлам. Фотоэлектронный сигнализатор уровня содержит источник излучения и фоторезистор, воспринимающий излучение. Поскольку при появлении шлама в воде на пути светового потока резко снижается освещенность фоторезисторов, возникает сигнал небаланса измерительной схемы, подающийся на устройство сигнализации либо в цепь автоматической продувки аппарата.
Автоматические мутномеры М-101 градуируются в единицах изменения коэффициента пропускания и имеют пределы измерения от 10 до 100 % при основной приведенной погрешности ±4 %. Датчики могут быть проточными и погружными. Анализаторы жидкости турбидиметрические АЖК-98 (ИЦ «Уралсемикондактор») имеют пределы измерения 0,3...53 мг/л (по каолину) при пределе приведенной погрешности ±2,5 %, выпускаются в проточном и переносном вариантах.
Нефелометрические анализаторы. В нефелометрических анализаторах интенсивность потока излучения, рассеиваемого частицами, находящимися в растворе, определяется уравнением Релея в следующей упрощенной форме:
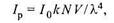
где I0, Iр — начальный и рассеянный потоки излучения;
V, N — объем шаровой частицы и их число;
λ — длина волны;
k — коэффициент пропорциональности.
Нефелометры в основном используются для анализа эмульсий и, в частности, для измерения содержания нефтепродуктов в сбросных водах.
Схема оптического блока микропроцессорного анализатора жидкости «Флюорат-02» (ф. «Эконикс»), содержащая три оптических канала: опорный, пропускания, люминесцентный, представлена на рис. 17.17. Излучение ксеноновой лампы 1, работающей в импульсном режиме, проходит через линзу 2, светофильтр 3 и светоделительную пластину 6. Сигнал фотоумножителя 7 является опорным, характеризующим световой поток Ф0. Ослабленный световой поток, прошедший через измерительную кювету 4, попадает на фотоумножитель 5 (канал пропускания). На фотоумножитель 9 через светофильтр 8 поступает либо рассеянный световой поток, либо потоки, связанные с люминесцентным или хемилюминесцентным излучением частиц, находящихся в растворе. Спектральный диапазон оптического излучения составляет 200...650 нм. Коэффициент пропускания может меняться от 10 до 100% при погрешности не более 2%. Память прибора содержит меню по 32 характерным методикам измерения и калибровочные коэффициенты по каждой методике. Для их реализации используется набор светофильтров, различные измерительные кюветы, красители. В круг содержащихся в воде анализируемых веществ входят: нефтепродукты, сульфиды, нитраты, железо, медь и др. Для упомянутых веществ нижние пределы измерения составляют соответственно в мг/л 0,005; 0,0005; 0,005; 0,05; 0,005.
Анализаторы жидкости нефелометрические АЖН-98 (ИЦ «Уралсемикондактор») выпускаются в погружном и проточном вариантах, имеют пределы измерения 0,05... 12 г/л (по каолину) при пределе приведенной погрешности ±4 %.
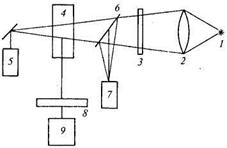
Рис. 17.17. Схема оптического блока анализатора «Флюорат»:
1 — ксеноновая лампа; 2 — линза; 3 — светофильтр; 4 — измерительная кювета; 5,7,9 — фотоумножитель; 6 — светоделительная пластина; 8 — светофильтр
'
Измерение концентрации газов, растворенных в воде и паре. С задачей измерения концентрации растворенных в воде газов встречаются как в промышленности, например при контроле теплоносителя на тепловых и атомных электростанциях, так и при анализе состояния вод в водоемах и отстойниках.
Измерение растворенного в воде кислорода. В зависимости от концентрации растворенного в воде кислорода для его измерения используется несколько методов. Для анализа микроконцентраций растворенного кислорода применяются амперометрические, кондуктометрические и колориметрические методы. При концентрациях, составляющих мг/л, используется термокондуктометрический метод.
Амперометрические кислородомеры относятся к электрохимическим анализаторам, принцип действия которых основан на измерении тока, протекающего через поляризованную электродную систему при наличии деполяризатора — кислорода.
Действующее напряжение Е в цепи, содержащей погруженные в раствор электроды, может создаваться за счет внешнего или внутреннего источника, последним служит гальваническая пара электродов. В кислородомерах этот источник сигнала используется чаще. Поляризованным электродом в приборах служит твердый катод, на котором происходит восстановление кислорода. В качестве материала катода используются золото, серебро, палладий, платина. Для сохранения постоянства характеристик прибора электроды не должны загрязняться продуктами электролиза. Для защиты электродов от анализируемой среды и обеспечения малого сопротивления электролита между электродами последние помещаются в фоновый электролит, индифферентный по отношению к электродам.
В промышленных кислородомерах применяются открытые электродные системы или закрытые полимерной мембраной. В первом случае кислород из анализируемой воды передается фоновому электролиту с помощью газопередающей системы. Во втором случае анализируемая вода омывает защищенную мембраной электродную систему. В качестве фонового электролита используется щелочной буферный раствор с рН = 8...10. В таких средах скорость восстановления кислорода на катоде на три порядка выше, чем в кислом электролите.
Схема мембранного амперметрического кислородомера КМА-08М.З, выпускаемого НПП «Техноприбор», представлена на рис. 17.18. Гальванический элемент образуется цинковым 1 (анод) и угольным 2 (катод) электродами. Угольный электрод поляризован. Пространство между электродами заполнено буферным раствором 3. Кислород из анализируемой воды 4 диффундирует через мембрану 5 в буферный раствор 3. При этом кислород восстанавливается на катоде, образуя ионы ОН- и Н+. Величина тока, протекающего во внешней цепи преобразователя, пропорциональна концентрации кислорода. Для коррекции влияния температуры на сигнал преобразователя используется медный термопреобразователь сопротивления 6. Анализируемая вода поступает с измерительную ячейку под постоянным давлением, создаваемым напорной трубкой 7. Кислородомер имеет четыре диапазона измерения. При нижнем пределе 0 верхние пределы составляют 19,99; 199,9; 1999; 19990 мкг/л. Прибор имеет автоматическое переключение диапазонов измерения, предел основной приведенной погрешности составляет ±4 %.
Растворенный в воде кислород измеряют анализаторы серии SIPAN (ф. Siemens); 871 DO, 873DO (ф. Foxboro); 7021, 7022 (ф. Honeywell) и др.
Измерение растворенного в воде водорода. Концентрация водорода в свежем паре на выходе пароперегревателей котлов характеризует интенсивность протекания процесса коррозии поверхностей нагрева. В связи с этим автоматические водородомеры получают все более широкое распространение на тепловых электрических станциях. Водородомер АВ-09 (НПП «Техноприбор») включает мембранный преобразователь, совпадающий по конструкции с представленным на рис. 17.18 преобразователем кислородомера. Различие состоит в материале электродов и типе буферного раствора. Водородомер имеет пределы измерения 0...20; 20...200; 200...2000 мкг/л при погрешности измерения ±4%. Прибор имеет цифровой индикатор и токовый выходной сигнал 0...5 (4...20) мА.
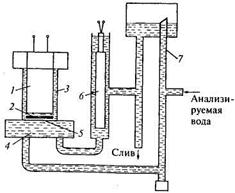
Рис. 17.18. Схема мембранного амперметрического кислородомера:
1, 2 — цинковый и угольный электроды; 3 - буферный раствор; 4 — анализируемая вода; 5 — мембрана;
6 — медное сопротивление; 7 — напорная трубка
Эксплуатация анализаторов состава жидкостей и их вспомогательных устройств. Анализаторы состава жидкостей в большей мере, чем другие первичные приборы, требуют правильного выбора точек отбора проб, жесткого соблюдения условий транспортировки и подготовки пробы, квалифицированного и своевременного проведения технического обслуживания, предусмотренного документацией на анализаторы и вспомогательные устройства.
Первичные преобразователи, рассмотренных анализаторов жидкостей, при соответствующих параметрах среды по температуре и давлению могут вводиться непосредственно в технологические объекты. К их числу относятся магистральные и погружные преобразователи кондуктометров, рН-метров. Хотя при этом отсутствуют помехи, вызванные транспортировкой и подготовкой пробы, тем не менее и в этом случае возможно получение непредставительных результатов измерения. Они вызываются неоднородностью состава жидкости по высоте резервуара или сечению трубопровода. Последнее более вероятно при ламинарном течении потока, чем при турбулентном. Наличие температурного градиента по длине и высоте резервуара, размещение преобразователей вблизи точек ввода потоков также может быть причиной отклонений показаний от действительных значений измеряемых величин. Все сказанное распространяется на правила установки отборных устройств, с помощью которых анализируемая жидкость выводится из трубопровода или резервуара. Поскольку параметры и состав отбираемых жидкостей могут быть самыми разнообразными, набор существующих вспомогательных устройств обеспечивает снижение температуры и давления, очистку пробы от механических и мешающих примесей, создание постоянного расхода.
Отборные устройства. Для отбора пробы гомогенной среды, движущейся в трубопроводе, применяется трубчатый зонд, схема которого для отбора пробы перегретого пара представлена на рис. 17.19, а. Трубка со скосом 45° навстречу потоку имеет глубину погружения до 20 мм. С увеличением глубины погружения растут механические усилия, действующие со стороны потока на зонд.
При необходимости усреднения пробы по сечению трубопровода используются щелевые зонды (рис. 17.19, б). Отбор осуществляется с помощью отверстий в трубке, их общее сечение составляет половину сечения трубки зонда. Для отбора представительной пробы скорости движения среды в зонде и в трубопроводе должны совпадать. При анализе состава насыщенного пара отбор необходимо проводить в таком сечении трубок, где не проявляется эффекта сепарации влаги стенками. Это требование объясняется тем, что концентрации примесей в паровой и жидкой фазах различны и требуется производить отбор усредненной пробы.
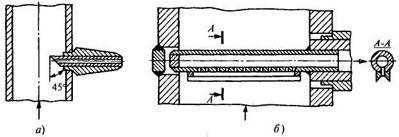
Рис. 17.19. Схема трубчатого (а) и щелевого (б) зондов
В качестве таких сечений выбираются трубопроводы на выходе барабанов котлов, сепараторов или сечения с высокими скоростями движения пара, где эффект сепарации влаги стенками не наблюдается. Для получения искусственной высокой скорости движения пара в месте расположения зонда используются трубы Вентури. Зонд устанавливается после суженной части трубы, где влажность пара выравнивается по сечению в результате отрыва пленки влаги от стенок трубопровода и дробления капель. Скорость пробы в зондах для насыщенного пара также должна совпадать со скоростью движения пара в трубопроводе.
Для первоначального отделения от анализируемой жидкости механических примесей используются сетчатые фильтры, окружающие отборную трубку. Для периодической очистки сетки предусматривается возможность пропуска через нее встречно направленного потока. Линии, через которые проба из отборного устройства поступает на вспомогательные устройства и анализатор, не должны иметь горизонтальных участков, чтобы в них не собирался шлам, газы. Минимальный угол наклона трубок в сторону продувочного вентиля или отстойника должен быть не менее 10°.
Материал линий определяется составом анализируемого вещества. Так, протекание процессов коррозии в линиях может уменьшить концентрацию кислорода в пробе по сравнению с исходной водой. В подобных случаях линии выполняют из коррозионно-стойких материалов. Для линий анализаторов жидкостей в основном используются бесшовные жесткотянутые и холоднокатаные трубы из стали 10 или бесшовные из нержавеющей стали с наружным диаметром 14...16 мм.
При анализе концентрации растворенных в воде или конденсате газов должна быть исключена возможность контакта пробы с атмосферой. Наличие последней может привести к погрешностям в оценке рН и электропроводности за счет десорбции СО2 и NH3 в воздух.
Устройства подготовки пробы. Для снижения давления пробы используют наборы дроссельных шайб, трубки с малым внутренним диаметром — ламинарные дроссели, регулировочные вентили. При анализе пара на содержание кремнекислоты холодильники должны размещаться перед дросселем, так как при снижении давления наблюдается выделение кремнекислоты и в анализаторы попадает обедненная проба. Таким образом, результаты анализа могут зависеть от взаимного расположения вспомогательных устройств, что следует учитывать при их компоновке.
Для снижения температуры пробы используются змеевиковые противоточные холодильники с расходом охлаждающей воды до 300 л/ч. В число устройств подготовки пробы могут входить сепараторы для удаления растворенных газов и различного рода фильтры для удаления механических и мешающих примесей. Так, при измерении удельной электропроводности конденсата, содержащего растворенный аммиак и гидразин, используют предвключенный Н-катионитовый фильтр. В кондуктометрических кислородомерах применяется предвключенный фильтр смешанного действия.
При отборе проб жидкостей или пара, находящихся под давлением, побудителей расхода не требуется, поскольку среды движутся самотеком и производится только стабилизация их расхода вследствие использования сосудов с перетоком, называемых напорными.
В анализаторах жидкостей используются разнообразные побудители расхода: диафрагменные, ротационные, перистальтические. Визуальный контроль за постоянством расхода обычно осуществляется ротаметрами.
Применяются два способа размещения анализаторов на технологических объектах. В одном случае анализаторы размещаются на минимальном расстоянии от точек отбора проб, что обеспечивает малое запаздывание и снижение погрешностей, обусловленных передачей пробы по длинным линиям. При этом приборы находятся в разных точках технологических объектов, на них влияют меняющиеся внешние воздействия, их обслуживание более трудоемко.
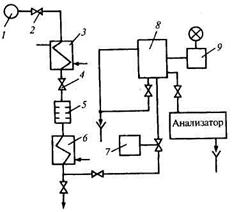
Рис. 17.20. Схема устройства подготовки пробы:
1 — пробоотборный зонд; 2 — запорный вентиль; 3 — холодильник; 4 — регулировочный вентиль;
5 — набор дроссельных шайб; 6 — водяной холодильник; 7 — электромагнитный клапан; 8 — бачок постоянного уровня; 9 — термоограничитель
В другом случае, учитывая сложность анализаторов и их высокие требования к условиям и уровню эксплуатации, приборы размещают в специальном помещении с регулируемым микроклиматом. При этом используются проточные первичные преобразователи и автоматизированные системы подготовки пробы. Это повышает надежность и качество работы приборов, упрощает их обслуживание, хотя первоначальные затраты на установку приборов возрастают. На электростанциях приборы химического контроля пароводяного тракта энергоблоков обычно находятся в отдельном помещении. Наличие в микропроцессорных анализаторах интерфейсов RS-232, RS-485 позволяет создавать системы химического контроля, интегрированные в локальные сети электростанций.
На тепловых и атомных электрических станциях для подготовки проб используются устройства УПП (рис. 17.20). Из пробоотборного зонда 1 анализируемая проба последовательно проходит следующие устройства: запорный вентиль 2, холодильник 3, регулировочный вентиль 4, набор дроссельных шайб 5, водяной холодильник 6, электромагнитный клапан 7, бачок постоянного уровня 8. Температура в бачке измеряется контактным термопреобразователем, при достижении 40 °С термоограничитель 9 сигнализирует о превышении температуры и закрывает клапан 7, прекращая подачу пробы в анализатор. Комплект устройств УПП-ТП (НПП «Технопри-бор») обеспечивает подачу пробы до 100 л/ч с температурой не более 40 °С и давлением 0,16 МПа.
Автоматический химический контроль теплоносителя первого контура АЭС с реакторами ВВЭР затруднен высоким уровнем радиоактивности, значительным количеством растворенного водорода и азота, высокой концентрацией борной кислоты. Отбор и подготовка проб для анализаторов химического контроля теплоносителя второго контура АЭС с реакторами ВВЭР не имеет особенностей по сравнению с тепловыми станциями сверхкритического давления.
Отбор и подготовка пробы при химическом контроле теплоносителя в реакторах РБМК производятся так же, как на тепловых электростанциях. Отличие состоит в том, что выпар из бачка постоянного уровня УПП направляется в систему газовых сдувок. Техническое обслуживание и ремонт анализаторов осуществляются в соответствии с действующими на АЭС правилами.
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 2730; Нарушение авторских прав?; Мы поможем в написании вашей работы!