
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
АО МО АО
|
|
|
|
O O
N
результирующий момент
Таким образом, молекула будет полярной, если содержит полярные связи и имеет не симметричную структуру, при которой центры распределения положительных и отрицательных зарядов в молекуле не совпадают. Полярность является важной характеристикой реакционной способности молекулы. Чем больше полярность, тем выше реакционная способность.
Поляризуемость – это способность электронной плотности связи перемещаться под действием внешнего электрического поля или других воздействий. Внешним электрическим полем может быть электрическое поле соседней молекулы, иона. Под его воздействием происходит смещение электронной плотности в полярных и неполярных молекулах и возникает наведенный или индуцированный дипольный момент. Это может вызвать резкое изменение реакционной способности молекулы.
Вывод.
Метод сыграл значительную роль в формировании теории химической связи. В настоящее время он остается основным подходом к объяснению природы связи в силу своей наглядности. МВС в большинстве случаев правильно объясняет структуру и свойства различных молекул. Однако имеются экспериментальные факты, которые не могут быть объяснены на основе данного метода. Например
1). Спектрофотографическими методами установлено наличие таких ионов как Н2+(состоит из двух протонов и одного электрона), Не2+ Но МВС не может объяснить этого явления, т.к. в этих ионах связь осуществляется 1 электроном.
2). МВС не объясняет магнитные свойства вещества. При наличии неспаренных электронов в атоме или молекуле их магнитные моменты способны взаимодействовать с приложенным внешним магнитным полем. Однако, например, молекула кислорода. Связь в ней осуществляют 2 р—электрона, все электроны в молекуле спаренны и она должна быть диамагнитная, но эксперементальные данные показывают обратное, она обладает парамагнитными свойствами
Эти факты можно объяснить используя ММО
ЛЕКЦИЯ № 4
Метод молекулярных орбиталей (ММО)
Если в МВС молекулы рассматриваются как системы, связанных локализованными общими электронными парами, то в ММО молекула рассматривается как единое целое, как сложный многоядерный "атом", где каждый электрон движется в поле всех ядер атомов и всех электронов, т.е. образуется молекулярное облако.
Основные принципы метода МО:
1. Молекула рассматривается как совокупность ядер и электронов, где каждый электрон движется в поле остальных электронов и всех ядер.
2. Состояние электрона описывается волновой функцией (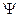 ), которая характеризуется определенным набором квантовых чисел. Эта функция называется молекулярной орбиталью. Волновую функцию (
), которая характеризуется определенным набором квантовых чисел. Эта функция называется молекулярной орбиталью. Волновую функцию (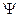 ), определяющую область наиболее вероятного нахождения и энергетический уровень электронов в молекуле, называют молекулярной орбиталью. Молекулярная орбиталь в общем случае многоцентровая. Теория, использующая представление о молекулярной орбитали для расчета различных характеристик молекул, называется методом молекулярных орбиталей.
), определяющую область наиболее вероятного нахождения и энергетический уровень электронов в молекуле, называют молекулярной орбиталью. Молекулярная орбиталь в общем случае многоцентровая. Теория, использующая представление о молекулярной орбитали для расчета различных характеристик молекул, называется методом молекулярных орбиталей.
3. Каждой молекулярной орбитали соответствует определенная энергия. Количество МО равно количеству электронов, участвующих в их образовании.
4. Совокупность молекулярных орбиталей молекулы, занятых электронами называется электронной конфигурацией молекулы. Конфигурация определяется следующими положениями:
I. принципом наименьшей энергии (электрон занимает орбиталь с меньшей энергией);
II. принципом Пауле (на одной МО не может быть более двух электронов с антипараллельными спинами);
III. правилом Хунда.
Математическая сущность метода МО заключается в построении орбиталей на основе орбиталей атомов, образующих молекулу. По форме МО близки к атомным. Пусть молекула состоит из атомов А, В, С с атомными орбиталями jА, jВ, jС, тогда волновая функция молекулы или МО может быть представлена в виде алгебраической суммы

Эта сумма называется линейной комбинацией атомных орбиталей (ЛКАО). Метод МО представленный с помощью ЛКАО дает возможность описать движение электронов в молекуле.
Рассмотрим пример образования молекулы водорода.
Атомы водорода имеют электроны, которые находятся на s – орбитали. При сближении атомов, ядро начинает притягивать электрон другого атома. Если межядерное расстояние становится близким удвоенному орбитальному радиусу, оба электрона оказываются связанными с обоими ядрами. Вместо двух s – орбиталей, возникает молекулярная орбиталь.
Какой же вид имеет МО? Если электрон находится около 1 атома, то МО сходна с его атомной орбиталью, с волновой функцией φ1. Если электрон оказывается у второго атома, то МО сходна с его атомной орбиталью φ2. Таким образом, движение электронов в молекуле характеризуется попеременно атомным орбиталям φ1 и φ2. Следовательно, МО равна линейной комбинации этих АО. Сложение 2-х АО дает МО
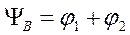
МО напоминает эллипсоид. Это означает, что движение электронов в молекуле охватывает оба ядра. Электроны находятся между ядрами. Такой характер движения способствует притяжению атомов и образованию молекулы.
Если МО получается в результате сложения функций АО, то энергия МО будет ниже, чем энергия исходных АО. Такая орбиталь называется связывающей.
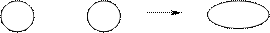 |
+
 В случае вычитания функций, МО имеет большую энергию, чем АО и называется разрыхляющей.
В случае вычитания функций, МО имеет большую энергию, чем АО и называется разрыхляющей.
Это приводит к изменению формы МО. Характер движения электрона меняется. В этом случае вероятность нахождения электронов посредине между ядрами равна нулю. Образуется 2-х центровая МО.

+
Таким образом переход электрона с s–орбитали на связывающую МО, сопровождается выделением энергии, и переход на разрыхляющую – требует затраты энергии.
При построении МО по методу ЛКАО соблюдают условия:
1) Взаимодействующие АО должны быть близки по энергии, т.к. большая энергетическая разница приведет к переходу электрона к атому с меньшей энергией и МО не образуется.
2) АО, при образовании МО должны перекрываться, чем полнее перекрывание, тем меньше энергия МО, тем прочнее связь.
3) АО, должны иметь одинаковые свойства симметрии.
Метод МО применяемый к двум АО водорода φА и φВ дает две различные МО с волновыми функциями ΨА и ΨВ. Каждой волновой функции отвечает собственный уровень энергии.
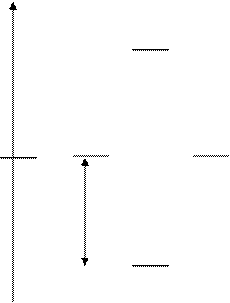
Процесс образования молекулы на основе метода МО представляют энергетической диаграммой, где по вертикали откладывают энергию (Е) орбиталей. Слева и справа на диаграмме проводят Е уровни атомных орбиталей, в середине – уровне МО, одна с более низкой Е (связывающая), другая с более высокой Е (разрыхляющая).
 Е
Е
а
Еа
Есвязи
б
Квантовая ячейка (□, ─) может быть занята одним или двумя электронами с антипараллельными спинами.
Переход  с атомных орбиталей на связывающую МО, приводящий к возникновению химической связи, сопровождается выделением энергии. Напротив, переход
с атомных орбиталей на связывающую МО, приводящий к возникновению химической связи, сопровождается выделением энергии. Напротив, переход  с атомных орбиталей на разрыхляющую МО требует затраты энергии.
с атомных орбиталей на разрыхляющую МО требует затраты энергии.
Мы знаем, что в наиболее устойчивом состоянии атома  занимают орбитали, характеризующиеся наименьшей энергией. Точно так же устойчивое состояние молекулы достигается тем, что
занимают орбитали, характеризующиеся наименьшей энергией. Точно так же устойчивое состояние молекулы достигается тем, что  занимают МО, отвечающие минимальной энергии.
занимают МО, отвечающие минимальной энергии.
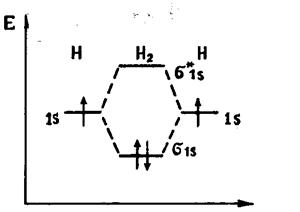
Поэтому в молекуле Н2 оба  перейдут с 1s орбиталей на связывающую МО.
перейдут с 1s орбиталей на связывающую МО.
Изобразим схему образования молекулы H2.
Атомные орбитали могут перекрываться, как по σ-, так и по π- типу (перекрывание по прямой соединяющей центры ядер или перпендикулярно этой прямой). Молекулярные σ – орбитали образуются из атомных s – орбиталей и рz – орбиталей. π – орбитали образуются из атомных рх и ру – орбиталей. При этом при их сложении получаем связывающие орбитали (например: σ или π), при вычитании – разрыхляющие (σ* или π*).
МО обозначают указывая после σ или π, те АО из которых образуется МО. Например: σ1s.
Порядок заполнения МО
Основной принцип заполнения МО аналогичен принципам заполнения АО.
1). Принцип наименьшей энергии;
2). Правило Хунда;
3). Принцип Паули.
Порядок заполнения МО должен быть таким, чтобы обеспечивалась минимальная энергия молекулярной системы. Т.е. первой заполняется орбиталь с наименьшей энергией. Если орбитали характеризуются одинаковой энергией, при их заполнение соблюдается правило Хунда. Заполнение электронов МО идет с принципом наименьшей энергии.
σ1s < σ*1s < σ2s < σ*2s < σ2pz < π2pх = π2py < π*2px = π*2py < σ*2pz
Этот порядок нарушается для бора, углерода и азота. Для этих атомов энергия орбиталей σ2р будет выше энергии π2px (π2py). Соответственно меняется порядок заполнения орбиталей π2pх = π2py < σ2pz < … затем по указанной выше схеме.
Т.о. молекула будет устойчива только в том случае, если сумма электронов на связывающих орбиталях будет превышать сумму электронов на разрыхляющих орбиталях. Если будет наоборот молекула будет неустойчива.
Удаление  с разрыхляющей орбитали стабилизирует молекулу, и наоборот, если
с разрыхляющей орбитали стабилизирует молекулу, и наоборот, если  удаляется со связывающей орбитали, то молекула дестабилизируется.
удаляется со связывающей орбитали, то молекула дестабилизируется.
Преимущества метода МО – возможность рассчитать основной энергетический уровень, а так же энергию возбужденного состояния. Преимущества этого метода проявляются в объяснении многоэлектронных атомов. Рассмотрим примеры.
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 658; Нарушение авторских прав?; Мы поможем в написании вашей работы!