
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Распад молекул электролитов на ионы в растворителях называется электролитической диссоциацией (ионизацией).
|
|
|
|
В результате концентрация веществ выравнивается. Третий этап сопровождается образованием сольватов, т.е. комплексов – частиц окруженных водными оболочками. При растворении веществ происходит диссоциация молекул электролитов на ионы.
Механизм образования растворов
Растворы – это гомогенные системы, состоящие не менее чем из 2-х независимых компонентов, образующих общую фазу.
Для характеристики составных частей растворов используют понятие растворитель и растворенное вещество. При растворении твердого вещества в жидкости, растворителем называют то вещество, которое сохраняет свои свойства. Например, - соль в воде, растворитель вода.
При растворении жидкости в жидкости имеет значение количество компонентов. Растворителем является тот компонент, которого больше в системе.
Например, спирт в воде: 40 % раствор – водный раствор спирта;
60 % раствор – спиртовой раствор.
Нами рассматриваются свойства жидких растворов имеющих большое значение для медицины и биологии.
Количественной характеристикой состава раствора является концентрация. Различают весовой способ выражения концентрации и объемный. Каждый из них имеет недостатки и преимущества. С различными видами концентраций вы ознакомитесь на занятиях.
Если растворяется твердое вещество в жидкости, то процесс начинает с отделения его отдельных молекул от поверхности. Это происходит под влиянием собственных сил колебания молекул вещества. Присутствие молекул растворителя способствует отрыву молекул от поверхности. На следующем этапе происходит распределение молекул во всем объеме раствора за счет диффузии.
 Диффузия – это процесс самопроизвольного проникновения одного вещества за счет теплового движения в среду другого вещества.
Диффузия – это процесс самопроизвольного проникновения одного вещества за счет теплового движения в среду другого вещества.
 Электролитическая диссоциация (ионизация) – процесс распада вещества на ионы, происходящий вследствие электролитического взаимодействия его с полярными молекулами растворителя.
Электролитическая диссоциация (ионизация) – процесс распада вещества на ионы, происходящий вследствие электролитического взаимодействия его с полярными молекулами растворителя.
Процесс диссоциации обратим, наряду с распадом идет процесс ассоциации (рекомбинации) – образование молекул из ионов.
В зависимости от поведения веществ при расплавлении и растворении различают: неэлектролиты и электролиты.
Неэлектролиты неполярны и не подвергаются диссоциации.
Электролиты – вещества, расплавы и растворы которых содержат подвижные ионы и проводят электрический ток.
Электролиты, которые практически полностью диссоциируют на ионы, называются сильными, а электролиты частично диссоциирующие называются слабыми. В растворах последних наряду с ионами существуют не диссоциированные молекулы.
Диссоциация зависит от температуры, концентрации (разбавлении), добавления одноименного иона.
Диссоциации сопровождается выделением или поглощением теплоты. Если этот процесс идет с поглощением теплоты, то нагревание вызывает увеличение степени диссоциации и наоборот.
При разбавлении раствора степень диссоциации возрастает. Это можно объяснить, если рассматривать диссоциацию как обратимый процесс и в соответствие с принципом Ле Шателье прибавление воды смещает равновесие вправо, увеличивая число диссоциированных молекул.
Kn Am + H2O ↔ n K+ + m A‾
Введение одноименных ионов (в равновесную систему смещает равновесие влево) уменьшает диссоциацию. Например
СН3СООН ↔СН3СОО‾ + Н+
введение в раствор соли СН3СООNа приводит к появлению избытка СН3СОО‾ и уменьшению диссоциации.
Количественно электролитическую диссоциацию можно охарактеризовать константой (К) диссоциации (ионизации), которая определяется законом действующих масс. Например, константа равновесия выше приведенного процесса записывается:
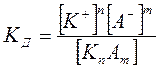
[K+] n [A‾] m - молярные концентрации ионов
[Kn Am] - молярные концентрации молекул электролита
Кд называется константой равновесия и является величиной постоянной для слабых электролитов. Чем больше Кд, тем сильнее диссоциирует электролит. Эта величина зависит от природы электролита, температуры, но не зависит от концентрации. Кд для сильных электролитов не является постоянной величиной и зависит от концентрации раствора.
Для количественной характеристики полноты диссоциации вводят степень диссоциации (ионизации) (a).
 Степень диссоциации равна отношению концентрации продиссоциировавших молекул (Сдис) к начальной концентрации электролита (С0).
Степень диссоциации равна отношению концентрации продиссоциировавших молекул (Сдис) к начальной концентрации электролита (С0).

|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 1405; Нарушение авторских прав?; Мы поможем в написании вашей работы!